文章图片
【维真生物 】提供现货产品、载体构建、病毒包装、细胞系建立等服务
MOI (multiplicity of infection) , 即感染复数 , 指的是感染时病毒与细胞数量的比值 。 一般认为MOI是一个比值 , 没有单位 , 其实其隐含的单位是pfu number/cell 。 但对于某些病毒如AAV病毒 , 无法用pfu表示病毒的数量 , 而是采用TU、IU、病毒颗粒(viral particles, v.p)或基因组数量(vector genome,v.g.)来表示病毒数量 。
慢病毒(Lentivirus)载体是基于HIV-1(人类免疫缺陷I型病毒)的单链RNA病毒载体 , 可感染分裂或非分裂细胞 , 并将外源基因有效地整合到宿主染色体上 , 且具有较低的免疫原性 , 被广泛应用于各种体外细胞实验中 。
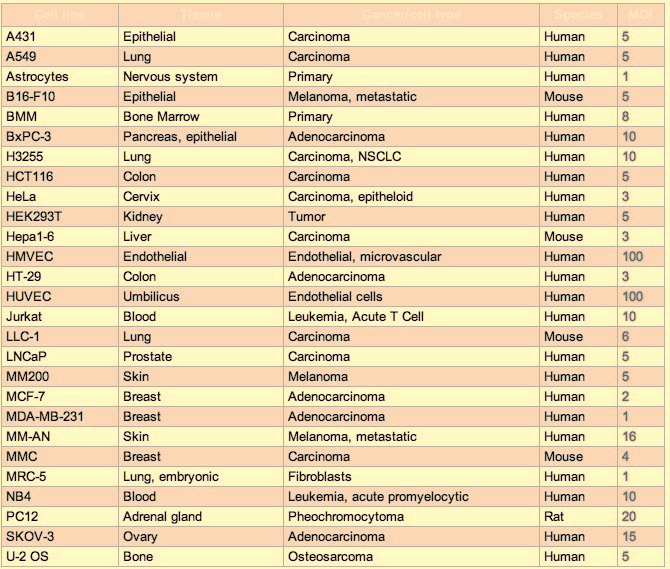
1. 常见细胞MOI参考值(慢病毒)
文章图片
2. 慢病毒MOI值摸索步骤
(1) 实验前信息准备
目标细胞系培养条件及增殖速度
排除细胞支原体污染
查阅文献 , 获得目标细胞参考MOI值(如没有相关文献 , 则可首先设置较大梯度的MOI进行预实验)
(2) MOI梯度设置
在查阅到的参考MOI值前后各设置2个梯度 , 每个梯度至少相差2倍 , 举例:查阅到某细胞系在文献中慢病毒MOI应用为10 , 则设置MOI梯度为2.5-5-10-20-40 。

文章图片
根据公式计算所需添加的病毒量:
MOI值=病毒滴度(TU/mL)×病毒体积(mL)/细胞个数
【状态|如何摸索慢病毒最佳MOI值】(3) 铺细胞
在96孔板中铺1×104个细胞/孔 , 培养基定容至100μL/孔;
(4) 慢病毒感染
依据所计算出的病毒体积 , 逐个孔添加慢病毒 , 并于感染次日更换新鲜培养基 。
(5)确定MOI范围
a.带荧光标签的慢病毒:观察荧光
感染后72小时后 , 于荧光显微镜下观察细胞状态和荧光情况 , 确定细胞状态较好且荧光数较多的孔 , 对应为较适宜的MOI值 。
b. 不带荧光标签的慢病毒:抗性筛选(puromycin/blasticidin等)
查阅相应抗性素在相应细胞株中的筛选浓度 , 于感染后72小时加入药物 , 培养3-5天 , 镜下观察 , 选取细胞存活率较高且细胞状态较好的孔 , 对应为较适宜的MOI值 。
(6)缩小MOI范围进行二次摸索(附加步骤)
如需较为精确的MOI值 , 可在步骤(5)中确定的MOI范围内再设置MOI梯度 , 实验方法同步骤(3)—(5) 。 举例:

文章图片
3. 慢病毒感染中的常见问题
(1)怎样提高慢病毒的感染效率?
细胞良好的生长状态是达到高感染效率的保证 。 必要时可在感染时加入助感染试剂ADV-HR来提高慢病毒的感染效率 。
(2)助感染试剂ADV-HR的使用浓度和使用方法是什么?
助感染试剂ADV-HR能够显著提高慢病毒的感染效率 , 并呈现剂量和时间依赖效应 。 但较高浓度的ADV-HR具有细胞毒性 , 影响细胞状态和感染效率 。 我们建议您务必于目的细胞中进行ADV-HR浓度梯度预实验 。 我们在HEK293中的实验表明 , 当ADV-HR使用浓度小于等于1.0×10-2mg/mL时 , 细胞状态良好 。
(3)慢病毒感染后为什么细胞中出现大量黑点 , 并影响细胞生长?
在排除细菌及真菌污染后 , 细胞中的黑点通常为细胞碎片 , 导致细胞破碎的原因有很多 , 但在慢病毒感染后 , 细胞破碎通常有两个原因:a. 慢病毒使用量过多 , 或细胞数量过少;b. 支原体污染 。
由于轻度的支原体污染并不影响细胞的生长和增殖 , 故支原体污染被许多实验室所忽略 。 但支原体易在病毒感染细胞后爆发 , 故会出现大量细胞碎片 。 我们建议在使用病毒制品时 , 应首先排除细胞、培养物及培养环境中的支原体污染 , 以节约您的宝贵时间 。
(4)慢病毒应如何保存?
建议您于收货后第一时间分装 , 并将病毒储存于液氮或-80℃ 。 切勿反复冻融!在未经冻融情况下 , 持续-80℃储存环境可质保6个月 , 超出该储存条件则需重新进行质控鉴定 。

文章图片
【维真生物 】提供现货产品、载体构建、病毒包装、细胞系建立等服务
推荐阅读
- 星链|石豪:在太空,马斯克和美国当局是如何作恶的
- 模拟|(图文+视频)C4D野教程:Windows11的壁纸动效是如何制作的?
- 帮信罪|带你了解什么是“帮信罪”如何避免落入陷阱
- 孩子|“双减”后 科学实践课如何做好“加法”
- 在线|企业配电房如何实现无线测温?安科瑞
- 尺寸|小米 12 / Pro 手机 3699 元起,雷军谈“双尺寸双旗舰”如何选择
- 视点·观察|拍照搜题等同作弊 App叫停后如何整改
- 沈余银|视频化趋势下,云技术如何让视频表达更高效?
- 容器|技术向:如何通过阿里云盘备份群晖 NAS 数据
- 喷头|[深圳3d打印]新手如何选购一台高质量3d打印机?