近日 , 中国科学院广州生物医药与健康研究院研究员陈捷凯课题组发现了RNA m6A修饰调控异染色质形成的新机制 , 阐明了RNA m6A阅读器YTHDC1在这一机制中的关键作用:抑制基因组中广泛分布的ERVK、IAP、LINE1等转座元件限制胚胎干细胞向全能性干细胞转化 , 相关研究成果以TheRNA m6A reader YTHDC1 silences retrotransposons and guards EScell identity为题 , 于北京时间3月4日发表在Nature上 。
RNA上的N6-腺苷酸甲基化( m6A)是mRNA上最丰富的RNA修饰 , YTH结构域是已知的能够特异性识别 m6A的结构域 , 因此 , RNA m6A可通过被含YTH结构域的阅读器蛋白(reader)识别 , 进而参与各种生物学功能 。 通过基因敲除实验 , 研究人员发现 ,m6A催化酶METTL3敲除的小鼠在E8.5前就胚胎致死 , 而大部分 m6A阅读器基因的敲除并不会导致胚胎致死 , 包括3个分布在细胞质中主要参与mRNA调控的YTH基因(Ythdf1-3) , 只有分布在细胞核中的Ythdc1敲除后会出现早期的胚胎致死 , 提示m6A可能具有与YTHDC1有关的其他尚不清楚的重要生物学功能 。
由于文献中至今尚未报道能够建立Ythdc1敲除的胚胎干细胞系 , 陈捷凯课题组运用条件敲除策略 , 针对编码YTH结构域重要部分的Ythdc1外显子7-9进行条件性敲除 , 发现敲除后细胞增殖能力迅速下降 , 基因表达谱出现2C-like(2C指受精卵卵裂后的二细胞期 , 小鼠在这一阶段启动合子基因组激活)的特征基因激活和逆转录转座元件激活 。 胚胎干细胞属于多能性干细胞 , 在小鼠胚胎发育中与囊胚内细胞团(ICM)的发育阶段相近 , 而2C-like细胞具备全能性 , 多能性干细胞在培养中会随机出现少量的2C-like细胞 , 这一多能性-全能性的转变过程是近年来干细胞领域的研究热点 , 科研人员希望通过了解其机制 , 发现维持全能性的可能方法 。 此前 , 科研人员已发现了RNA m6A调控胚胎干细胞退出多能性 , 该研究工作进一步发现了RNA m6A在全能性-多能性转变中的调控作用 。
课题组在此前的工作中发现H3K9me3催化酶SETDB1在体细胞重编程、转座元件抑制、全能性-多能性转化中的重要作用(NatureGenetics 2013 , Cell Reports 2020) , 因为表型一致 , 研究人员进一步研究了RNAm6A是否参与SETDB1-H3K9me3的调控 。
遗传物质以染色质的形式存在 , 其中 , 活跃转录的部分为常染色质 , 致密的异染色质代表被沉默的遗传信息 。 组蛋白H3K9me3是异染色质的重要修饰 , 也是细胞命运决定的重要机制 。 在小鼠胚胎干细胞(mES细胞)中 , 除了组成型异染色质(着丝粒、端粒等) , H3K9me3主要标记遍布基因组的逆转录转座子(Retrotransposons)上并沉默这些区域 。 逆转录转座子上的H3K9me3由SETDB1负责催化 , 敲除SETDB1会导致这些元件重激活并使胚胎干细胞转化为具有全能性特征的、类似2细胞期的细胞(2C-like细胞) 。 但SETDB1是如何特异性地被募集到逆转录转座子区域的?目前已有一些机制研究表明 , 哺乳动物进化过程中会通过含KRAB结构域的锌指蛋白的进化来特异性沉默一部分转座元件(KRAB结构域会通过KAP1招募SETDB1) , 但该机制并不覆盖所有各种类型的转座元件 , 提示还存在未发现的机制 。
该研究发现 , YTHDC1能够直接结合转座子元件(TE)转录出来的RNA上的 m6A修饰 , 并招募SETDB1到相应的染色质位置 , 催化转座元件上的H3K9me3形成异染色质并使这些转座元件沉默 。 敲除Ythdc1会导致Setdb1依赖性的H3K9me3信号大幅下降 , 证明了YTHDC1是SETDB1介导逆转录转座子沉默的重要机制环节 , 也揭示了RNA m6A调控染色质的功能 。
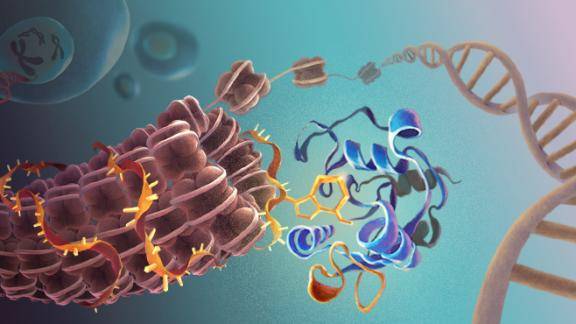
文章图片
图.RNAm6A结合蛋白YTHDC1调控异染色质形成
【干细胞|研究人员发现RNA调控染色质的新机制】来源:中国科学院广州生物医药与健康研究院
推荐阅读
- 牛上|英媒文章:2021年最有趣的科学发现
- 安全|复旦教授发现400多个Android漏洞 谷“鸽”16个月后才修复
- 奇葩趣闻|男子加了2万的油发现是中围石油:同名公司曾被中国石油起诉商标侵权
- 行星|天文学家发现迄今规模最大的一组星际行星
- 生物地球化学过程|我国科学家发现第五条甲烷产生途径
- 数智|【受尊敬企业会客厅】 陈明键:在元宇宙,打造用人工智能发现药物的“乙世界”
- the|工人在美邦联将军雕像底座中发现了一个有130年历史的时间胶囊
- 足迹|远古发现丨2021年这些有关“远古”的新发现,哪个曾让你大吃一惊?
- 足迹|2021这些有关“远古”的新发现 哪个让你大吃一惊?
- 化石|远古发现丨2021年这些有关“远古”的新发现,哪个曾让你大吃一惊?






