作者 | 东北一度
数据支持 | 勾股大数据
新冠疫情的持续凸显了疫苗的重要性以及全球对疫苗的迫切需求 。 借此契机 , mRNA疫苗登上了舞台 。 mRNA疫苗运用场景不仅限于传染病预防 , 在治疗肿瘤、免疫疾病等领域具有令人期待的发展空间 。
mRNA疫苗作为最新一代技术 , 包括沃森生物、复星医药、智飞生物在内的众多企业通过不同途径进行了布局;mRNA疫苗因其颠覆传统免疫激活路径 , 提供稳定高保护率和不错的安全性 , 深受市场关注 。
1
mRNA疫苗治疗原理
mRNA疫苗是一种核酸疫苗 , 通过将病毒的部分mRNA片段注入人体细胞内产生抗原 , 再由此激发特异性免疫反应 , 达到形成免疫记忆的效果 。
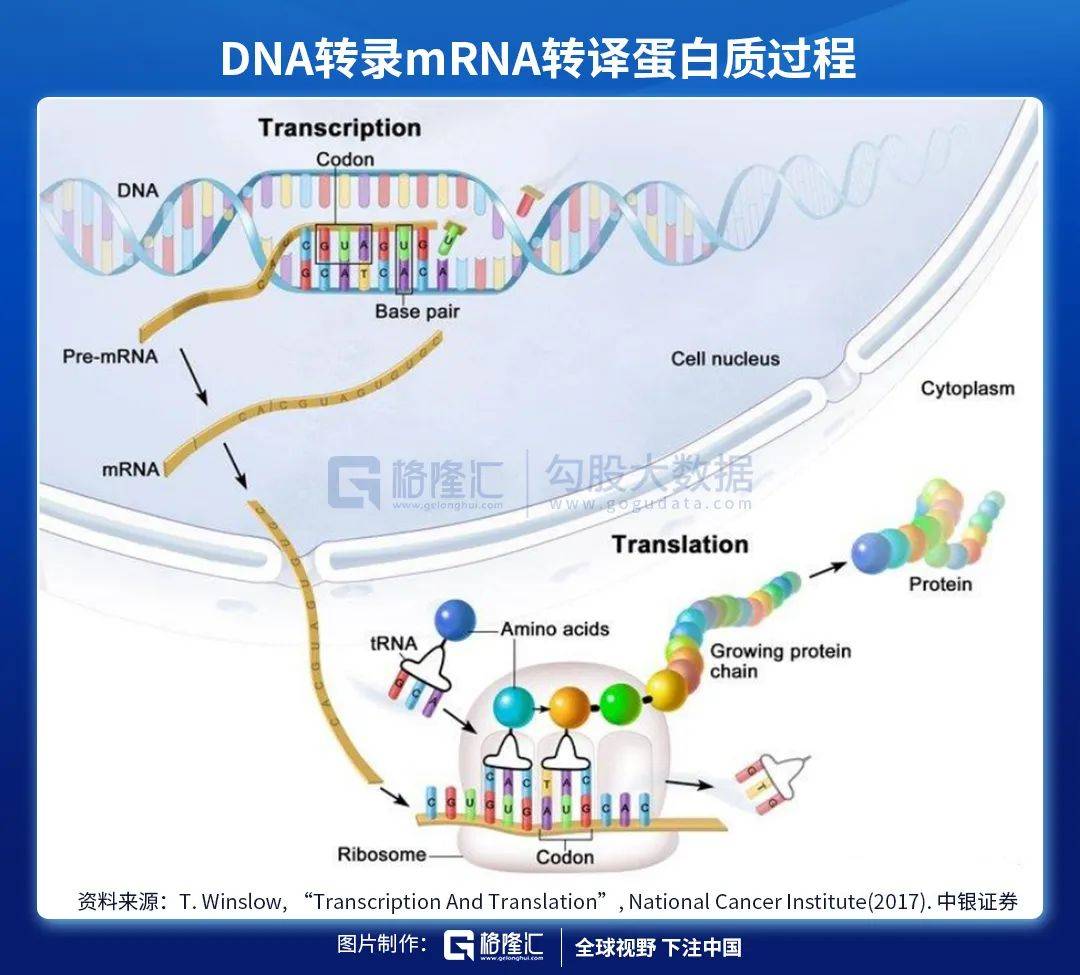
DNA是存储人体遗传信息的载体 。 人体内绝大部分细胞都带有DNA 。 但是DNA本身无法直接对人体产生影响 , 各类蛋白质才是能够左右表象的物质(例如:抗原、激素) 。 DNA需要转化为蛋白质才能够将遗传信息表达出来 。
整个DNA转化为蛋白质的过程分为两大步 , 第一步:DNA转化为mRNA , 这一步骤称为转录(transcription) , 发生在细胞核内;第二步:mRNA转化为蛋白质 , 这一步骤称为转译(translation) , 发生在细胞质中 。
具体来分析mRNA新冠疫苗的机理 。 mRNA疫苗中的mRNA片段编码新冠病毒表面的某些蛋白或受体 , 例如刺突蛋白(S蛋白) 。 疫苗递送人工编辑后的mRNA进入人体细胞 , 在体内“借用”人体自身细胞转译mRNA为蛋白质 。
此类mRNA在经过转译后会表达成为病毒所具有的某种抗原蛋白 。 虽然产生的抗原是由自身细胞制造 , 但由于其氨基酸序列具有外源性 , APC中的TLR并不识别此段序列 , 因此仍旧会激发B细胞和T细胞针对此抗原蛋白的特异性免疫反应 , 并建立免疫记忆 。
文章图片
2
LNP递送系统:递送疫苗有效物质进入预定轨道的运载火箭
mRNA疫苗的生产可分为三大阶段 , 一是DNA原液制备 , 二是mRNA原液的制备 , 三是利用脂质微粒进行包封 。
如今 , 病毒遗传信息序列的解码和反向序列合成已不是难题 。 如何将合成好的mRNA序列递送进入人体细胞变成了mRNA疫苗研发的重要挑战之一 。
【免疫|mRNA疫苗技术路线优势显著,重点关注国内标的】人体细胞结构从外至内可分为细胞膜(cell membrane)、细胞质(cytoplasm)、细胞核(nucleus) 。 mRNA转译成蛋白质的过程发生在细胞质中 , 因此 , mRNA疫苗要发挥作用 , 必须先将编辑好的mRNA转递进细胞质中 。
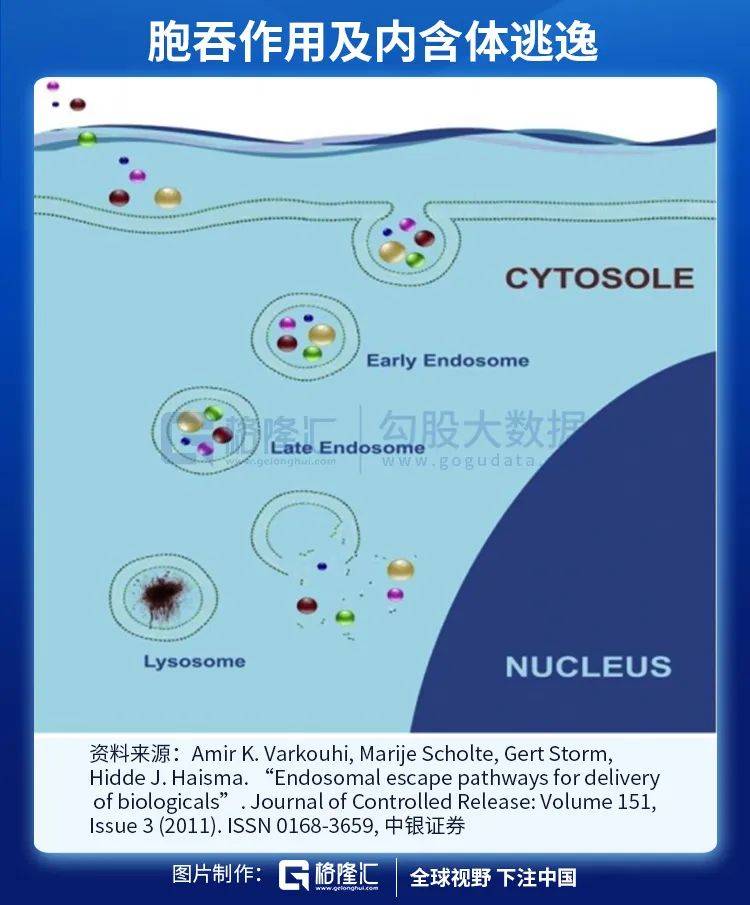
进入细胞质需要通过细胞膜 , 细胞膜由磷脂双分子层构成 , 磷脂分子头部具有亲水性 , 尾部具有疏水性 , 两层磷脂尾部相对形成双分子层 , 能够有效控制水分子、离子、大分子物质通过 。 mRNA作为大分子(300-5000kDa) , 在不破坏细胞膜的前提下 , 进出细胞只能以内含体(endosome)通过胞吞作用(endocytosis) 。
通常情况下 , 内含体进入细胞质后 , 会被直接送至溶酶体(lysosome)进行分解 。 为保证mRNA在转译前保持完整性 , mRNA需要在内含体与溶酶体结合前打破内含体包膜(endosomal disruption)并逃离 。
逃离内含体进入细胞质后 , mRNA便会在细胞质内游动 , 直至到达核糖体(ribosome)并在此转译为肽链 , 最终折叠成为蛋白质 。
对于mRNA疫苗和药物 , 递送系统有两大职责:一是有效包裹和保护mRNA在到达靶点前维持稳定 , 二是帮助mRNA有效成分进入细胞 , 三是在mRNA到达溶酶体前将其释放进入细胞质中 。
文章图片
LNP是目前最具潜力的递送载体之一 。 LNP(Lipid Nanoparticle)是脂质微粒的总称 , 其中又包括脂质胶团(micelle)、脂质体(liposome)等 。 LNP与细胞膜的组成成分相似 , 均由脂质分子构成 。 脂质分子的两条长尾通常呈平行状态 , 在此状态下 , 脂质形成的双分子层稳定 。
在进入细胞质酸性环境后 , 部分脂质的头部质子化 , 呈现阳离子形态 , 与其他阴性离子态的脂质分子相吸引 , 尾部张开 。 原本双分子层的形式被破坏 , 形成头部聚集在一起的环状 。 之前包裹在内的mRNA便可逃逸出内含体 , 进入细胞质等待转译 。
3
mRNA疫苗相较于其他技术路径疫苗的优劣势分析
mRNA疫苗 vs. 灭活疫苗
与传统灭活疫苗、裂解疫苗相比 , mRNA疫苗激活特异免疫的路径不相同 。 传统疫苗激活特异性免疫的方式是直接将抗原蛋白注射进入人体 , 引起免疫反应;而mRNA是将编码病毒抗原的mRNA注入体内 , 由人体自身细胞产生对应的抗原 , 以此激活特异性免疫 。
理论分析 , mRNA疫苗能够呈现更多的抗原 , 同时能更持久地激活巩固特异性免疫 。 原因在于 , 传统灭活疫苗的抗原呈递数量是一定的 , 即最终到达体内引起免疫反应的抗原数量只能够小于或等于疫苗中含有的抗原数量 。
同时 , 灭活疫苗呈递抗原的过程是一次性的 , 注射时疫苗呈递的抗原即为所有抗原 , 这些抗原的降解时长即为持续激活免疫的时长 , 此后不会有新增抗原 。
而mRNA疫苗抗原呈递的过程是可短暂持续的 , 呈递的mRNA可指导多个核糖体产生抗原蛋白 , 直至mRNA降解 。 由于细胞能够不断根据mRNA生产抗原蛋白 , 因此抗原数量受疫苗剂量所限制较小 , 从时间维度上看 , 抗原不会在短时间内迅速被消耗完毕 。 抗原数量水平越高、保持时长越长 , 形成的特异性免疫记忆越强烈 , 免疫应答更快、持续时间越长 。
mRNA疫苗 vs. DNA疫苗:更高效 , 逆转录风险较小
与核酸疫苗中另一路径的DNA疫苗相比 , mRNA疫苗更有效也更安全 。 DNA疫苗需要将包裹的有效成分递送通过两层屏障:细胞膜和细胞核膜 , 最终进入细胞核内开始抗原蛋白的表达 。 多层屏障导致有效成分难以进入反应场所 , 免疫激活更难 。
同时 , 由于DNA疫苗呈递的有效成分需要进入细胞核内 , 导致外源遗传片段逆转录进入人体DNA的概率增加 , 引起肿瘤癌症的概率增加 。 相较而言 , 由于mRNA疫苗导入的外源物质不需进入细胞核 , 发生外源遗传片段逆转录进入人体自身DNA的概率较小 , 因此引起肿瘤癌症的概率极小 。
mRNA疫苗 vs.病毒载体疫苗
另一大受到较高关注度的载体平台是病毒载体平台 , 常见的类别有腺病毒(Adenovirus)、腺相关病毒(Adeno-Associated Virus , AAV)、慢病毒(lentivirus) 。 病毒载体通过去除病毒本身的有害物质 , 保留感染能力 , 将目标物质递送进入细胞内 , 由细胞产生抗原蛋白 , 进而引起特异性免疫反应 。
病毒载体反应的一大缺陷是 , 若接种者本身体内含有针对此病毒载体的抗体(如腺病毒、AAV、慢病毒 , 而非针对目标抗原的抗体) , 或在短时间内快速产生了抗体 , 则病毒载体疫苗无法将有效成分递送进入预定的细胞质内 。
相比之下 , LNP的结构由脂质分子构成 , 载体引起免疫反应的几率较小 , 能够更有效地递送有效成分至目标靶点 。 除此之外 , 部分病毒平台有发生逆转录的概率 , 会将外源基因整合进入人体DNA中 , 可能导致肿瘤、免疫疾病等 。
同时 , 病毒载体疫苗具有更高的机会成本 。 当人体接受病毒载体疫苗注射后 , 体内会自动产生针对此载体的抗体和其他特异免疫反应 。 此后再次运用相同或相似病毒载体作为递送系统给药时(例如一些肿瘤治疗药物) , 会更容易遭到免疫系统的攻击 , 难以成功将药物递送至靶点 。
mRNA疫苗的临床运用历史始于2020年新冠疫情 。 根据WHO数据 , 截止2021年5月7日 , 全球共有15款mRNA疫苗在研 , 其中包括已纳入WHO紧急使用名单(Emergency Use Listing , EUL)的2款mRNA疫苗:由辉瑞/BioNTech联合研发的BNT162b2 , 以及由Moderna研发的mRNA-1273 。
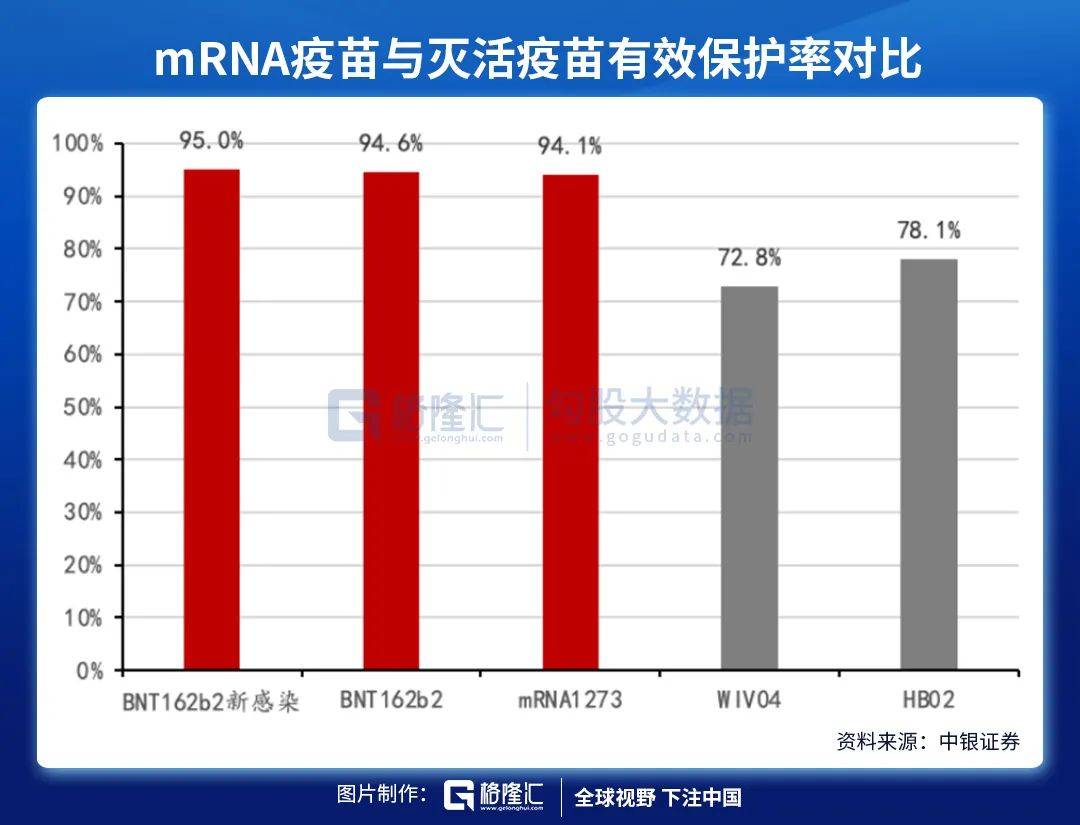
2020年11月18日 , 辉瑞发布了BNT162b2的III期临床试验结果 , 结果显示疫苗整体保护率高达95% 。 2021年3月31日 , Moderna发布了mRNA-1273的III期临床试验结果 , 结果显示疫苗整体保护率也达到94.1% , 与BNT162b2的数据非常接近 。
除了有效保护率外 , 疫苗的另一重要指标是不良反应发生的种类和概率 。 总体来说 , 灭活疫苗因其成熟的技术和研发生产经验 , 不良反应发生频率较低 , 反应程度也较为温和 。 mRNA疫苗则运用了全新的技术 , 目前得到的安全数据只反映了接种后短期内可能发生的不良反应 , 是否会对人体造成长期的影响还需要时间进行长期的观察 。
临床实验数据显示 , mRNA疫苗的各项不良反应发生率都较为明显地高出灭活疫苗对应水平 , 会让接种者在短期内产生更多的不适感 。 但在临床试验中并未出现严重甚至致命性的不良反应 。
文章图片
注:从左至右分别为BNT162b2对从未感染过新冠病毒人群的保护率 , BNT162b2整体保护率 , mRNA1273整体保护率 , 国药/武汉灭活疫苗整体保护率 , 国药/北京灭活疫苗整体保护率 。
4
国内mRNA疫苗标的
截至2021年7月16日 , 全球已经接种疫苗约35.8亿剂 , 接种率为45.87%;其中中国接种量14.3亿剂 , 接种率99.1%;美国接种量3.36亿剂 , 接种率为100.48% 。 全球主要国家中接种率最高的为英国 , 接种率为120.35% 。
短期内 , 国内新冠疫苗市场已被传统的灭活疫苗占据 。 目前已有6家企业的新冠疫苗可在国内销售 , 其中北生所、武汉所、科兴、康希诺是有条件批准 , 智飞生物和康泰生物是紧急使用 。
长期来看 , 新冠的大范围传播增加了病毒变异的可能性 。 现有疫苗能否防范变异病毒成为社会关心的热点之一 。 普通群众对疫苗有效性感到担忧 , 投资者则关心是否会影响现有疫苗的放量情况 。 针对这一问题 , mRNA疫苗效力遭到削弱的幅度有限 , 而对于传统灭活疫苗将会是一个严峻挑战 。
由于灭活疫苗的保护器为6个月 , 截至2021年12月10日左右将有超过2亿人需要第二轮新冠疫苗接种 。 根据2021年6月10日数据 , 截至当日接种了一剂次的人数为3.984亿人 , 这一部分群体在2021年7月10日前将接种第二剂次 , 并且在2022年1月10日前开始进行第二轮的接种 , 届时国内市场将有约4亿剂次的新需求 。 这为mRNA疫苗提供了极大的机会 。
国内暂未有mRNA获批上市 , 这一市场目前仍处于空白状态 。 在第二轮新冠疫苗需求到来之际 , 国产mRNA疫苗的竞争将会打响 。
目前国内市场中 , mRNA疫苗研发进展最快的是艾博生物与沃森生物、军科院共同研发的ARCoV , 以及复星医药由BioNTech引进的BNT162b2 。
沃森生物
2020年5月11日 , 沃森生物公告与苏州艾博生物签署关于新冠mRNA疫苗的合作协议 。 艾博生物具有mRNA疫苗设计的核心技术 , 其CEO英博先生曾供职于国际mRNA疫苗巨头Moderna 。 沃森生物则拥有临床注册、研究、产业化和营销方面的丰富经验 。 今年5月 , 墨西哥宣布将在5月底开展此疫苗的III期临床试验 。
聚焦前沿技术 , 提前布局新一代核酸类药物 。 4月27日 , 上市公司与圣诺生物签署了抗病毒核酸干扰药物的合作协议 。 圣诺生物负责完成药物的临床申报所需的临床前研究 , 公司获得该药物在中国大陆及港澳台地区的独家权利 。
13价肺炎疫苗开始贡献收入 , 国际化销售锦上添花 。 2021Q1沃森生物子公司13价肺炎疫苗获批签发164.3万瓶 , 达到2020年全年批签发量的36.8% 。 同时 , 子公司与摩洛哥MarocVax达成排他性协议 。 MarocVax保证在收到完整产品注册档案后18个月内获得上市许可 。 2021年 , 此疫苗于摩洛哥的销量约为200万剂 。 技术转移后 , MarocVax将继续采购至少等同于200万剂的疫苗原液 。
根据券商一致预测 , 沃森生物预计21-23净利润13亿、18亿、26亿 。
复星医药
7月14日 , 复星医药在股东大会上回复投资者问询时表示 , 药监局对mRNA新冠疫苗“复必泰”的审定工作已基本完成 , 专家评审已通过 , 处于行政审批阶段 , 复星医药已与BioNTech提前启动生产准备工作 , 有望成为国内首个获批的新冠mRNA疫苗 。
今年5月9日 , 公司公告子公司复星医药产业与BioNTech设立合资公司 , 以实现mRNA新冠疫苗产品的本地化生产及商业化 。 双方分别认缴合资公司注册资本的50% , BioNTech以技术和许可等无形资产方式出资 。 复星医药产业应提供产能可达10亿剂的生产设施 。
另外 , 复星医药在CART领域也获批了国内第一个产品 。 2021年6月23日 , NMPA批准了复星子公司复星凯特的奕凯达的上市申请 , 用于治疗复发难治性大B细胞淋巴瘤 。 复兴凯特在针对中国患者的难治性侵袭性大B细胞淋巴瘤的实验中ORR达到79.2% , 与Yescarta的临床和真实世界数据高度相似 。 2020年Yescarta全球销售额约6.07亿美元 , 同比增长33% 。
复星在创新药方面持续投入 , 研发费用率稳定在10%左右 , 逐步接近国际制药巨头水平 。 阿达木单抗、曲妥珠单抗、CAR-T细胞治疗等多个产品已获批上市 , 成为公司营收新的增长点 。 截至2020年末 , 公司在研创新药项目达56项 , 为未来长期发展做好战略储备 。
根据券商一致预测 , 复星2021-2023年公司净利润预计44 亿、53亿、61亿 。
考虑到康希诺生物半年报预告中50%左右的净利率 , 沃森和复星的业绩预估都偏保守 , 值得重点关注 。
推荐阅读
- IT|全球供应25亿剂疫苗 科兴上半年营收110亿美元
- 蛋白|二代新冠疫苗来了!打了一代,还需要它吗?
- 国药|二代新冠疫苗来了!打了一代,还需要它吗?
- IT|以色列正式批准开放第四剂新冠疫苗接种 限免疫力低下人群
- IT|美国CDC:无论接种疫苗与否 民众应避免邮轮旅行
- 疫苗|中国生物:全球首支获批使用二代新冠疫苗将在阿联酋用于序贯接种
- IT|南非研究显示两剂强生新冠疫苗可大幅降低Omicron导致的住院
- 国家|张云涛:中国新冠疫苗研发处于国际第一方阵
- 疫苗|国内首个自主研发四价流脑疫苗正式获批
- 疫苗|奥密克戎对抗体中和作用存在大量逃逸现象







