价键理论 弄懂杂化轨道理论就全靠它了
在化学学习中公认的难点就是杂化轨道理论,这个理论对于空间结构能力不强的学生来说简直就是天书,今天化学姐就好好给大家解释一下分子杂化轨道理论,一定要仔细看哦~
文章插图
杂化轨道理论
价键理论简明地阐明了共价键的形成过程和本质,成功解释了共价键的方向性和饱和性,但在解释一些分子的空间结构方面却遇到了困难。例如CH 4 分子的形成,按照价键理论,C原子只有两个未成对的电子,只能与两个H原子形成两个共价键,而且键角应该大约为90°。但这与实验事实不符,因为C与H可形成CH 4 分子,其空间构型为正四面体,∠HCH= 109.5°。为了更好地解释多原子分子的实际空间构型和性质,1931年鲍林提出了杂化轨道理论(hybridorbitaltheory),丰富和发展了现代价键理论。1953年,我国化学家唐敖庆等统一处理了 s-p-d-f 轨道杂化,提出了杂化轨道的一般方法,进一步丰富了杂化理论的内容。
1.杂化轨道理论的基本要点
杂化轨道理论从电子具有波动性、波可以叠加的观点出发,认为一个原子和其他原子形成分子时,中心原子所用的原子轨道(即波函数)不是原来纯粹的 s 轨道或 p 轨道,而是若干不同类型、能量相近的原子轨道经叠加混杂、重新分配轨道的能量和调整空间伸展方向,组成了同等数目的能量完全相同的新的原子轨道 ——杂化轨道(hybridorbital),以满足化学结合的需要。这一过程称为原子轨道的杂化(hybridization)。
下面以CH 4 分子的形成为例加以说明。
基态C原子的外层电子构型为2 s 2 2 p x 1 2 p y 1 。在与H原子结合时,2 s 上的一个电子被激发到2 p z 轨道上,C原子以激发态2 s 1 2 p x 1 2 p y 1 2 p z 1 参与化学结合。当然,电子从2 s 激发到2 p 上需要能量,但由于可多生成二个共价键,放出更多的能量而得到补偿。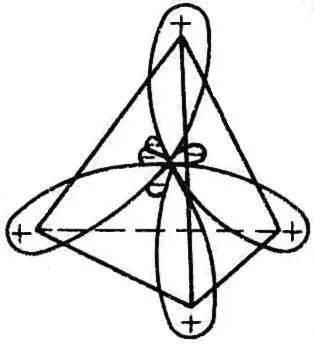
文章插图
图1.6 sp 3 杂化轨道示意图
在成键之前,激发态C原子的四个单电子分占的轨道2 s 、2 p x 、2 p y 、2p z 会互相“混杂”,线性组合成四个新的完全等价的杂化轨道。此杂化轨道由一个 s 轨道和三个 p 轨道杂化而成,故称为 sp 3 杂化轨道。经杂化后的轨道一头大,一头小,其方向指向正四面体的四个顶角,能量不同于原来的原子轨道(图1.6)。
形成的四个 sp 3 杂化轨道与四个H原子的1 s 原子轨道重叠,形成( sp 3 - s )σ键,生成CH 4 分子。
杂化轨道成键时,同样要满足原子轨道最大重叠原理。由于杂化轨道的电子云分布更为集中,杂化轨道的成键能力比未杂化的各原子轨道的成键能力强,故形成CH 4 分子后体系能量降低,分子的稳定性增强。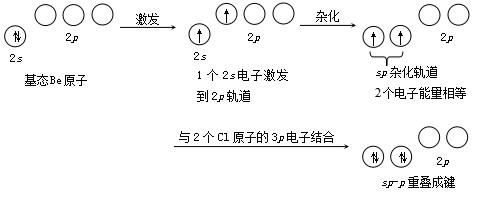
文章插图
CH 4 分子形成的整个杂化过程可示意如下: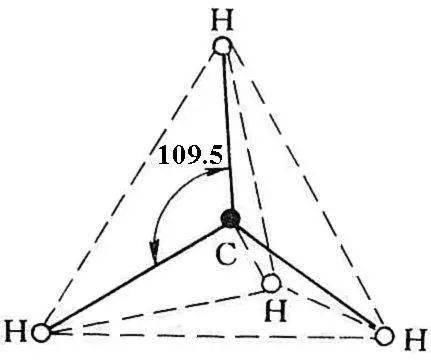
文章插图
图1.7 CH 4 分子的空间结构
化合物的空间构型是由满足原子轨道最大重叠的方向所决定的。在CH 4 分子中,四个 sp 3 杂化轨道指向正四面体的四个顶点,故四个H原子的1 s 轨道在正四面体的四个顶点方向与四个杂化轨道重叠最大,这决定了CH 4 的空间构型为正四面体,四个C-H键间的夹角为109.5°(图1.7)。
由以上讨论可归纳得到杂化轨道理论的基本要点为:
⑴同一个原子中能量相近的原子轨道之间可以通过叠加混杂,形成成键能力更强的一组新的原子轨道,即杂化轨道。
⑵原子轨道杂化时,原已成对的电子可以激发到空轨道中而成单个电子,其激发所需的能量可以由成键时放出的能量得到补偿。
⑶n个原子轨道杂化后只能得到n个能量相等、空间取向不同的杂化轨道。
必须注意,孤立原子轨道本身不会杂化形成杂化轨道。只有当原子相互结合形成分子需要满足原子轨道的最大重叠时,才会使原子内原来的轨道发生杂化以获得更强的成键能力。
2.杂化轨道的类型
根据参与杂化的原子轨道的种类和数目的不同,可将杂化轨道分成以下几类。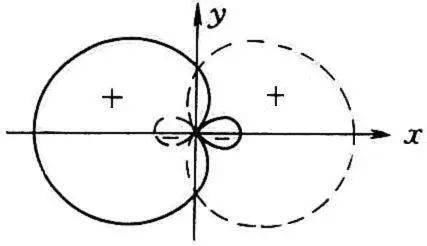
文章插图
图1.8 sp 杂化轨道示意图
⑴ sp 杂化
能量相近的一个n s 轨道和一个n p 轨道杂化,可形成二个等价的 sp 杂化轨道。每个 sp 杂化轨道含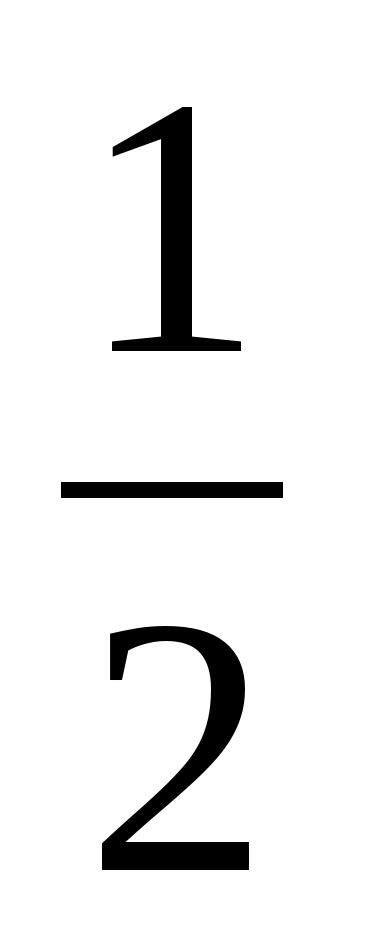
文章插图
的n s 轨道和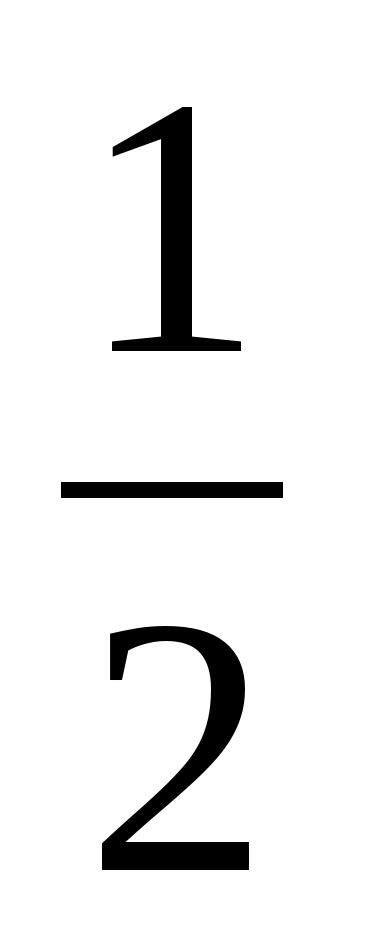
推荐阅读
- 理论 黑洞是什么,它又是怎样形成的,一起来认识下吧
- 宇宙 理论上宇宙应存在大量文明,为何却没有文明联系我们,原因是什么?
- 物理学家 天文学中早已被推翻, 但还被普通民众视为常识的理论
- 学者 导致恐龙灭绝的陨石从哪儿来?哈佛学者提出新理论|一周科技
- 理论 宇宙探索星系从何而来宇宙之外还有宇宙吗
- 物理学家 违反爱因斯坦的理论定律:这一黑洞新发现,打破了黑洞无毛定理
- 常数 宇宙膨胀跟发胖有关系吗?从理论上来看,有那么一丢丢!
- 预言家 黑洞伟大的“预言家”,首张黑洞照片诞生,霍金黑洞理论终获证实
- 学者 近年来一些学者提出了相空间理论来解释量子纠缠
- 理论 重大突破!光伏设备第一次实现:效率突破100%的理论极限!





