
文章图片
实验原理:
原代细胞(primaryculturecell)是指从机体取出后立即培养的细胞 。
原代细胞的培养是指直接从机体取下细胞、组织和器官后立即进行培养 。 因此 , 较为严格地说是指成功传代之前的培养 , 此时的细胞保持原有细胞的基本性质 , 如果是正常细胞 , 仍然保留二倍体数 。 但实际上 , 通常把第一代至第十代以内的培养细胞统称为原代细胞培养 。
动物组织经胰蛋白酶等消化、分散 , 获得单个细胞 , 再生长于培养皿中 。 大多数组织可以制备原代细胞 , 但生长的快慢及难易程度不一 。 肾和睾丸最常用 , 甲状腺细胞生长较慢 , 只用于某些特定的病毒如猪传染性肠胃炎病毒的培养 。
原代细胞的分离方法:
一、悬浮细胞的分离方法
组织材料若来自血液、羊水、胸水或腹水的悬液材料 , 最简单的方法是采用1000r/min的低速离心10分钟 。 经离心后由于各种细胞的比重不同可在分层液中形成不同层 , 这样可根据需要收获目的细胞 。
二、实体组织材料的分离方法
对于实体组织材料 , 由于细胞间结合紧密 , 为了使组织中的细胞充分分散 , 形成细胞悬液 , 可采用机械分散法(物理裂解)和消化分离法 。
(一)机械分散法
特点:简便、快速,但对组织机械损伤大 , 而且细胞分散效果差,适用于处理纤维成分少的软组织 。
(二)消化分离法
组织消化法是把组织剪切成较小团块(或糊状) , 应用酶的生化作用和非酶的化学作用进一步使细胞间的桥连结构松动 , 使团块膨松 , 由块状变成絮状 , 此时再采用机械法 , 用吸管吹打分散或电磁搅拌或在摇珠瓶中振荡 , 使细胞团块得以较充分的分散 , 制成少量细胞群团和大量单个细胞的细胞悬液 , 接种培养后 , 细胞容易贴壁生长 。
1、酶消化分离法常采用胰蛋白酶和胶原酶
(1) 胰蛋白酶分散技术
胰蛋白酶(简称胰酶)是广泛应用的消化剂 。 胰蛋白酶是一种胰脏制品 , 对蛋白质有水介作用 , 主要作用于赖氨酸或精氨酸相连接的肽键 , 使细胞间质中的蛋白质水介而使细胞分散开 , 在常用的蛋白酶中由于产品的活力和纯度不同 , 对细胞的消化能力也不同 , 胰蛋白酶对细胞的作用 , 取决于细胞类型、酶的活力、配制的浓度、消化的温度、无机盐离子、pH以及消化时间的长短等:
①细胞类型 。 胰蛋白酶适于消化细胞间质较少的软组织 , 能有效地分离肝、肾、甲状腺、羊膜、胚胎组织、上皮组织等 。 而对含结缔组织较丰富的组织 , 如乳腺、滑膜、子宫、纤维肉瘤、肿瘤组织等就无效 , 但若与胶原酶合用 , 就能增加其对组织的分离作用 。
②酶的活力 。 市售的胰蛋白酶 , 其活力都经过测定而有效 , 但配制时必须新鲜 , 需保存在低温冰箱中 , 消化时的pH和温度都要适宜 , 否则会影响活力 , 细胞的分散直接与酶的活力有关 , 最终使用活力为1:200或1:250,56℃pH8.0时活力最强 。 该酶为粉剂 , 保藏时要防潮 , 室内温度不宜过高 , 保存时间不能太长 , 若粉剂结团块 , 说明该部分受潮或失效 。
③酶的浓度 。 胰蛋白酶一般采用的浓度为0.1%-0.25%(活力1:200或1:250) , 但遇到难消化的组织时 , 浓度可适当提高 , 消化时间适当延长 。 浓度高对细胞有毒性 , 而较低浓度的胰蛋白酶在培养液中可促进细胞的增殖 , 若培养液中加入血清 , 其少量胰蛋白酶可被血清中抗胰蛋白酶因子所清除 。
④温度 。 一般认为胰蛋白酶在56℃时活性最强 , 但由于对细胞有损害而不能被采用 , 常使用的温度为37℃ , 通常在37℃进行消化比室温作用快 。
⑤pH 。pH8-pH9是胰蛋白酶活力适宜范围 , 但随碱性的增加其活力也随之减少 , 活性强分散快 , 细胞也容易被消化下来 , 消化分离细胞时PH只能选用7.6-8.0之间 , 否则对细胞有损伤 。
⑥无机盐 。 离子若用含有钙和镁的盐类溶液来配制胰蛋白酶时 , 可以发生抑制胰蛋白的消化作用 。 因此 , 在配制时应采用无钙镁离子的PBS配制 。
⑦消化时间 。 如果细胞消化时间过长 , 可以损害细胞的呼吸酶 , 从而影响细胞的代谢 , 一般消化时间为20分钟为宜 , 冷消化时使用低浓度消化液 , 于4℃过夜也可 。
分离方法如下:
①过夜冷消化将取得的组织用Hanks液洗三次 , 剪成碎块大小为4毫米左右 , 用Hanks液洗2-3次以除去血球和脂肪组织 , 再加入0.25%的胰蛋白酶 , 摇匀后放4℃过夜 , 次日再用Hanks液洗涤 , 弃去上清 , 共洗2-3次 , 然后 , 加入少量营养液吹打分散 , 细胞计数 , 按适当的浓度分瓶培养 。
②多次提取消化法多次提取消化法有以下三种:
热消化多次提取--将剪碎的细胞块加入0.25%胰蛋白酶37℃水浴中消化15-20分钟 , 然后经洗涤后用营养液分散制成细胞悬液 , 按合适的浓度分瓶培养 , 然后将留下的未彻底消化的组织按上述方法操作 , 再消化提取细胞 。
冷消化多次提取--方法同上 , 只是消化温度为4℃ 。
先热消化后冷消化--将组织块先用胰蛋白酶于37℃下消化20分钟经洗涤后用营养液分散 , 制成悬液 , 剩余未消化的小组织块经洗涤后用胰酶于4℃下过夜 , 次日再提取细胞 , 分散成悬液 , 分瓶培养 。
(2)胶原酶(Collagenase)消化法
胶原酶是一种从细菌中提取出来的酶 , 对胶原有很强的消化作用 。 适于消化纤维性组织、上皮组织以及癌组织 , 它对细胞间质有较好的消化作用 , 对细胞本身影响不大 , 可使细胞与胶原成分脱离而不受伤害 。 该酶分离效果好 , 即使有钙、镁离子存在仍有活性 , 故可用PBS和含血清的培养液配制 , 即操作简便又可提高细胞成活率 , 最终浓度200u/mL或0.1-0.3mg/mL.此酶消化作用缓和 , 无需机械振荡 , 但胶原酶价格较高 , 大量使用将增加实验成本 。
经过胶原酶消化后的上皮组织 , 由于上皮细胞对酶有耐受性 , 可能有一些上皮细胞团块尚未被完全消化开 。 成小团块的上皮细胞比分散的单个上皮细胞更易生长 , 因此不必要再进一步消化处理 。
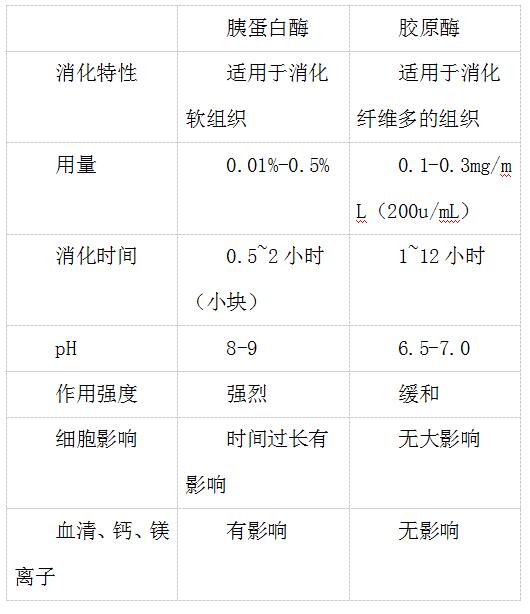
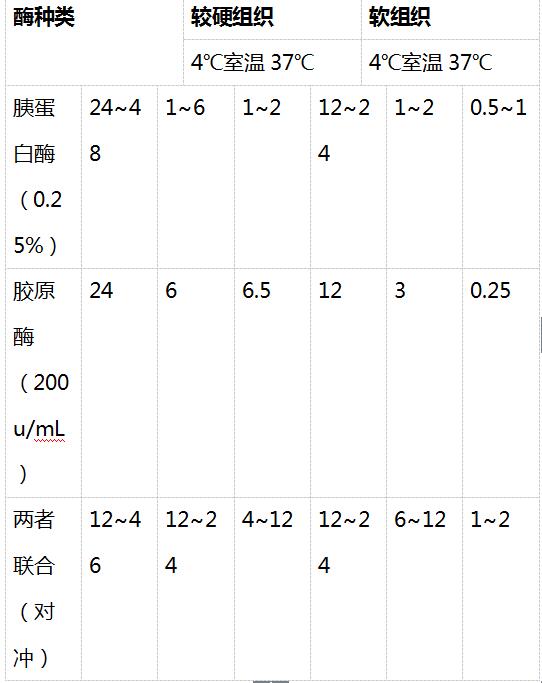
鉴于胰蛋白酶和胶原酶的生物学活性(见表4-1)和在不同浓度下消化各种组织小块所需的时间(小时)有差异(见表4-2) , 以及两者价格不等 , 有人采用胶原酶与胰蛋白酶并用 , 同时还可加透明质酸酶(对细胞表面糖基有作用) , 采用两者的联合消化作用 , 对分散大鼠和兔肝、癌组织非常有效 。
表4-1 胰蛋白酶和胶原酶生物活性的差别
文章图片
表4-2 胰蛋白酶和胶原酶在不同温度下消化各种组织小块时所需时间(小时)(0.5-1cm3)
文章图片
除上述两种最常用的消化酶外 , 还有链霉蛋白酶、粘蛋白酶、蜗牛酶、弹性蛋白酶、木瓜蛋白酶 , 近年来 , 还有一种从灰霉菌中提取的Pronase新酶分散细胞更佳 。
2、非酶消化法(EDTA消化法)
EDTA是一种非酶消化物 , 又称螯合剂或Versene , 全名为乙烯二胺四乙酸 。 常用不含钙、镁离子的PBS配成0.02%的工作液 , 对一些组织 , 尤其是上皮组织分散效果好 , 该化学物质能与细胞上的钙、镁离子结合形成螯合物 , 利用结合后的机械力使细胞变圆而分散细胞或使贴壁细胞从瓶壁上脱离 。
3、消化分离法的操作步骤
(1)剪切把组织块剪碎 , 呈1-5mm大小的组织块 。
(2) 加液漂洗将碎组织块在平皿(或三角烧瓶)中用无钙镁PBS洗2-3次(采用倾斜 , 自然沉降法) 。
(3)消化加入消化液(胰蛋白酶或胶原酶或EDTA)于37℃水浴中作用适当时间(中间可轻摇1-2次) , 若组织块膨松呈絮状可终止 , 若变化不大可更换一次消化液 , 继续消化直至膨松絮状为止 。 胰蛋白酶消化时间不宜过长 。
(4)弃去消化液采用倾斜自然沉降或低速离心法尽量弃去消化液 。
(5)漂洗将含有钙、镁离子的培养基沿瓶壁缓缓加入 , 中止消化反应 , 采用漂洗法洗2-3次后 , 加入完全培养基 。
(6)机械分散采用吸管吹打或振荡法 , 使细胞充分散开后用纱网或3~4层无菌纱布过滤后分瓶培养 , 若要求不高可采用倾斜自然沉降5~10分钟 , 吸上层细胞悬液进行分瓶培养 。
4.消化分离法的注意事项
(1)组织块必须漂洗2-3次以除去组织中的钙、镁离子和血清对胰蛋白酶和EDTA的抑制作用 。
(2)胰蛋白浓度不宜过高 , 作用时间不能太长 , 以避免毒性作用 。
(3)消化后组织不仅要尽量弃去消化液 , 以避免毒性产生 , 而且动作要轻 , 以避免膨松的细胞随漂洗而丢失 。
原代细胞的培养步骤
一、静置贴壁细胞(包括半贴壁细胞的培养)培养要求
1、细胞要通过充分漂洗 , 以尽量除去消化液的毒性;
2、细胞接种时浓度要稍大一些 , 至少为5×108细胞/L;
3、培养基可用Eagle(MEM)或DNEM培养;
4、小牛血清浓度为10%-80%;
5、应在37℃5% CO2的培养箱中培养;
6、在起始的2天中尽量减少振荡 , 以防止刚贴壁的细胞发生脱落 , 漂浮;
7、待细胞基本贴壁伸展并逐渐形成网状 , 应将原代细胞换液;
8、用骨髓或外周血中的悬浮细胞经静置培养1周时 , 应将细胞悬液经低速离心后换液 。
二、悬浮细胞的培养要求
1、原代培养时要尽量去除红细胞;
2、短期培养 , 可在含10%小牛血清的RPMI1640培养基中进行;
3、细胞浓度可在5-8×109/L范围内进行分瓶试验;
4、长期培养时 , 淋巴细胞中要加入生长因子 , 白血病细胞中要加入少量的原患者血清 , 以利细胞生长;
5、细胞换液一般每隔3天需半量换液一次;
6、细胞传代一般待细胞增殖加快、细胞密度较高时才能进行 。
三、原代细胞的维持
1、贴壁细胞长成网状或基本单层时 , 未达到饱和密度 , 需采取换液方式来更新营养成分以满足细胞继续生长繁殖的需要;
2、换入等量完全培养基或换成含2%小牛血清的维持液;
3、悬浮细胞细胞培养基中不仅会发生转化而且会发生分裂繁殖 , 此时培养基中的营养成分并不能维持细胞的营养需求 , 需进行换液 。 通常采用半量换液的方法;
四、原代细胞培养的首次传代
原代培养后由于悬浮细胞增殖 , 数量增加甚至达饱和密度;贴壁细胞的相互汇合 , 使整个瓶底逐渐被细胞覆盖 , 细胞难以继续生长繁殖 , 需要进行分瓶培养 , 这种使原代细胞经分散接种的过程称之为传代 。
首次传代应注意以下几点:
(1)细胞生长密度不高时 , 不能急于传代 。
(2)原代培养的贴壁细胞需控制消化时间 。
(3)吹打已消化的细胞应减少机械损伤 。
(4)首次传代时细胞接种数量要多一些 。
(5)首次传代培养的pH应偏低些 。 小牛血清浓度可加大至15%~20%左右 。
五、其他培养法
(一)组织块培养法
组织块培养是常用、简便易行和成功率较高的原代培养方法 。 其基本方法是将剪成的小组织团块接种于培养瓶(或皿)中 , 瓶壁可预先涂以胶原薄层 , 以利于组织块粘着于瓶壁 , 使周边细胞能沿瓶壁向外生长 。
(二)悬浮细胞培养法
对于悬浮生长的细胞 , 如白血病细胞、淋巴细胞、骨髓细胞、胸水和腹水中的癌细胞和免疫细胞无需消化 , 可采用低速离心分离 , 直接培养 , 或经淋巴细胞分层液分离后接种培养 。
(三)器官培养
器官培养是指从供体取得器官或组织块后 , 不进行组织分离而直接在体外的特定环境条件下培养 , 器官培养可保持器官组织的相对完整性 , 可用于重点观察细间的联系、排列情况和相互影响 , 以及局部环境的生物调节作用 。
【作用|知识分享:原代细胞的制备、培养】备注:维真生物公司致力于为广大科研工作者提供优质的病毒包装服务 , 服务项目包括:科研级和临床级腺病毒、慢病毒、腺相关病毒(AAV)的包装、质粒载体构建、TALEN 基因敲除、基因突变等 。 目前为止公司已经拥有人源现货质粒库(18 000个)、腺病毒现货库(12 000个)、腺相关病毒(AAV)现货库 , 公司还拥有丰富的定制服务项目 。 真诚欢迎您咨询与选购!
推荐阅读
- 新机|快准稳,捕捉每个高光瞬间! 刘衡分享EOS R5拍摄体验
- 问答|紧追B站加码知识类内容,抖音上线“学习频道”
- 显示器|华光昱能知识--DP2.0跟DP1.4有那些不一样?
- 审判|直接服务“三城一区”主平台,怀柔科学城知识产权巡回审判庭成立
- 词条|百度百科上线2500万词条,超750万用户参与共创科普知识内容
- 风险|筛选风险词、用实体类型推断限售商品,阿里安全夺冠知识图谱大赛
- 字节跳动|抖音上线学习频道,为知识内容增加一级入口
- 知识科普|直管内径、凸缘管内径密封快速接头 管内壁粗糙的管口格雷希尔GripSeal连接器
- 消息资讯|污水处理市场-PLC远程监控如何发挥巨大的作用-华辰智通
- 疫苗|奥密克戎对抗体中和作用存在大量逃逸现象










