
文章图片
在我们鉴定基因敲除(KO)细胞是否建立成功时 , 除了基因水平的测序、PCR等方法外 , 蛋白水平的Western Blot验证也是一个重要的方法 。 特别是对于文章发表中结果的呈现 , Western Blot图尤为重要 。 但在实际实验的过程中 , 偶尔也会出现测序鉴定为KO纯合子但WB实验却有条带的情况 , 即蛋白残留 。 那么基因敲除细胞时蛋白残留是如何产生的呢?
1 由于目的基因的多转录本引起的蛋白残留
基因一般含有多个不同的转录本 , 在选择敲除位点时 , 有时会很难保证覆盖所有的转录本 , 而未被影响到的转录本就有可能正常转录翻译从而表达出具有部分功能域的蛋白 。 因此 , 我们在设计KO细胞方案时 , 应综合考虑数据库基因信息、文献 , 甚至通过预实验 , 从而尽可能地覆盖多个转录本 , 当然 , 这就对方案设计的人员有较高的技术和经验要求 。
2 由于基因的可变剪切引起的蛋白残留
可变剪切指当某个外显子被破坏或缺失时 , 其转录的mRNA前体通过不同的剪接方式产生不同的mRNA剪接异构体的过程 , 是调节基因表达和产生蛋白质多样性的重要机制 。 当我们构建KO细胞时 , 敲除位点处外显子被切割后 , 包含在内含子中的RNA剪接规则同时被破坏 , 在一定情况下 , 缺失的外显子序列在RNA剪切阶段被略过 , 直接将其上游的外显子与下游的外显子相连 , 形成一种全新的mRNA , 从而继续蛋白的翻译 。
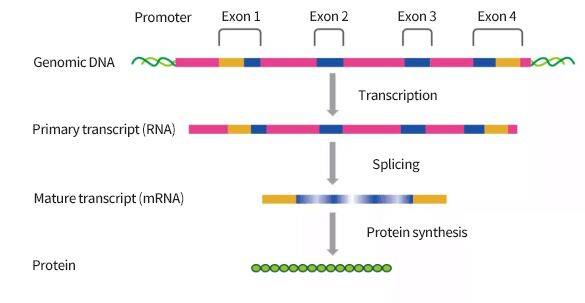
文章图片
可变剪切发生机制
【Western|KO细胞中目的蛋白残留问题及解决方案】3 外因——Western Blot抗体的选择
Western Blot检测技术是基于抗原抗体的特异性结合的原理 , 且抗体并不是识别整个目的蛋白 , 而是识别某段特定氨基酸序列或其中某部分功能结构域 , 即抗体的特异性 。 因此 , 在采用Western Blot检测KO细胞是否存在蛋白残留表达时 , 如果选择的敲除位点相对靠后 , 而抗体与蛋白的结合区域若存在于敲除位点之前 , 便可能会出现抗体与N端残留蛋白的结合 , 从而导致Western Blot检测条带的出现 。 不过对于这种情况 , 目的蛋白的功能很可能已经丧失 。
我们该如何规避蛋白残留风险?
首先 , 也是最重要的 , 就是gRNA的设计!gRNA的设计决定了切割位点的位置 , 因此gRNA的设计通常也是避免蛋白残留问题的关键 。 特别对于移码突变的敲除策略 , gRNA的设计更为重要 , 一般建议设计3条gRNA , 并在cell pool阶段根据切割效率的高低来选择 。
有gRNA设计经验的同学对那几个常用的gRNA设计网站应该比较熟悉 , 但网站设计的结果只是一个参考 , 我们不仅需要综合多个数据库的设计结果、也要结合相关的文献报道 , 同时参考常用抗体信息的分析 , 并根据实际情况进行阶段性的WB测试 , 从而实现所建立的KO细胞无蛋白残留 。
另外 , 对于长度较短、又无法找到合适切割位点的基因 , 我们也可采取大片段敲除或全敲的策略 , 确保得到的纯合子细胞蛋白不残留 。
推荐阅读
- 最新消息|中围石油回应被看成中国石油:手续合法 我们看不错
- 安全|Redline Stealer恶意软件:窃取浏览器中存储的用户凭证
- 截图|靠抄袭对标苹果?心动黄一孟指责小米新版游戏中心抄袭TapTap
- |南安市交通运输局:履行行业监管职责,扎实推进公路工程中介服务专项整治
- 系列|2021中国航天发射圆满收官!年发射55次居世界第一
- 项目|常德市二中2021青少年科技创新大赛再获佳绩
- 科学|中阳县北街小学:体验科学魅力
- 华依|中信证券:惯性导航有望成为L3及以上自动驾驶的标配产品
- 爆发|中信证券:自动驾驶渐行渐近,惯性导航刚需爆发
- 微信|微信支付“九宫格”全面支持开通中国银联云闪付







