中枢神经系统是由许多不同类型的细胞构成的 , 包括神经元和神经胶质细胞 。 其中 , 根据不同的形态、大小和功能 , 神经元可以分为很多类型 。 而神经胶质细胞主要包括星形胶质细胞、少突胶质细胞和小胶质细胞 。

文章图片
【维真生物】AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
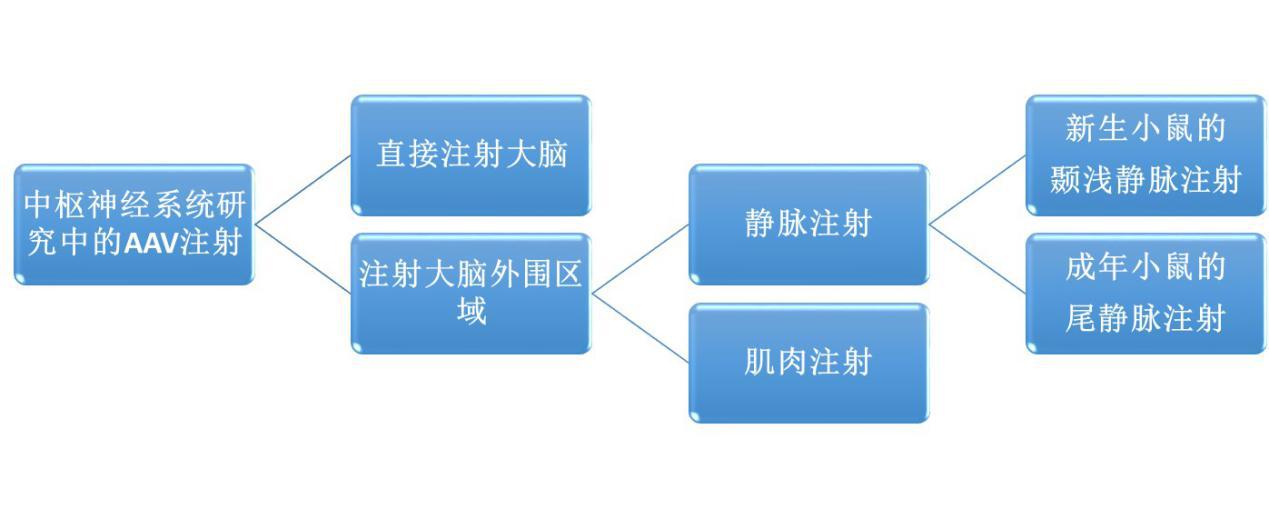
AAV在中枢神经系统(central nervous system , CNS)中的应用包括很多方面 , 比如在神经系统疾病和中枢神经系统损伤中的研究和治疗 , 以及某些神经系统疾病模型的局部转基因研究等 。
由于AAV的血清型、转录因子和注射位点的不同 , AAV在大脑中介导的转基因通常不是均一的 , 这种不均一表现在时间和空间(不同细胞种类的特异性)方面 。 除此之外 , AAV病毒制备的技术(影响纯度和滴度)、病毒注射的方法也会大大影响到AAV介导的转基因的效率 。 值得注意的是 , AAV感染后所使用的检测方法和目的蛋白的自然属性(胞内蛋白/分泌蛋白/转运蛋白)等因素也会影响到最终对转基因效果的评价 。 组织学染色 , 比如免疫组化或单/双免疫荧光可以帮助观察转基因表达的分布特征 , 但却不能量化评价病毒感染的效率 。 对脑提取物进行ELISA或RT-qPCR可以定量转基因效率 。
事实上 , 通过将AAV直接注射大脑或大脑外围区域(肌肉或静脉注射)能够产生不同的转导模式 。 已经有文献证明AAV9可在小鼠/猫和非人灵长类动物中穿过血脑屏障 。 并且 , AAV载体可以从肌肉逆行运输到脊髓运动神经元(27-30) 。 简单来说 , 就是运动神经元的轴突接触到AAV病毒 , 并将其传递给胞体 。 实验表明 , AAV1的逆行效率较高 。 本文主要介绍几种在神经科学研究中常用的AAV注射方法 。
文章图片
一.通过立体定位仪直接向脑内注射AAV(需佩戴手套和口罩)
目前 , 成年雌雄大鼠和小鼠的大脑图谱都可通过文献和书籍获得 。 立体定位手术时 , 颅骨上最常用的注射参照点就是前囱 , 也就是中矢状冠状缝的交叉点 。 具体的注射部位 , 可依据研究的需要而确定 。 微创技术可以避免炎症 , 以降低转导细胞的排斥反应 。
1.安装定位仪: 在生物安全柜中安装立体定位框架和工具 。
2.准备并吸满病毒悬液:在喷嘴出安装超微量注射器 , 把针尖浸在准备好的AAV病毒悬液中 , 并使用“快速反向”功能吸满 。
3.排除空气:使用“快速正向”功能检查泡沫 , 知道在针头处出现一滴液体 。 用浸泡在0 , 1M NaOH溶液中的棉花轻轻拭去针尖的液滴 。
4.麻醉大鼠:选取250g左右的大鼠 , 通过25 G 1毫升注射器注射甲苯噻嗪(10mg/kg)和氯胺酮(100mg/kg) 。
5.固定大鼠:首先将大鼠的下切牙固定在齿棒上 , 然后用耳棒通过大鼠的外耳道进行固定 , 并固定头部 。 检查颅骨是否是水平的 , 并确保两个眼睛在同一水平线上 。 在每只眼睛中滴入一滴聚丙烯酸 , 以防麻醉造成眼睛干燥 。 调整光源对准大鼠的头部 , 剃去头部的毛并用酒精消毒清洁 。
6.切口并暴露前囱点:用刀片在头皮上前后轴切口 , 并用钳子保持刀口开放状态 , 用棉球吸去血 。 去除骨膜以便看到前囱 。
7.暴露λ点:调整齿夹的垂直位置 , 使得前囱点和λ点的高度一致 , 如果λ点的位置难以看到 , 让切口处干燥5-10min后再寻找 。
8.确定前囱点的AP和ML坐标和目标注射点的距离:将针垂直于前囱点 , 并记录AP和ML坐标的数值 。 参考大鼠脑图谱的标记的目标注射部位的AP和ML值 , 计算前囱点与目标注射部位的AP和ML坐标 , 并做标记 。
9.确定前囱点的DV坐标和目标注射点的距离:用钻头在颅骨上打洞 , 注意不要损伤硬脑膜 。 把针尖置于硬脑膜的表面并测量出前囱点DV的坐标 。 计算目标注射部位的DV坐标 。
10.注射AAV:缓慢垂直移动注射器针尖到达目标注射部位 , 慢慢地将针插入并静置5min 。 然后 , 以0.2 μ l/min的速度 , 将2μL的病毒悬液注射入脑 。 结束后 , 需要静置5min再将注射器缓慢移出 。
11.缝合并做标记:缝合头皮 , 并做耳标 。
12.大鼠术后的护理:将大鼠单独放在一个干净的笼子里 , 直到醒来 。 第一天需要让大鼠在独立的通风笼中度过 。
13.处理针头和手术材料:先用0.1 M NaOH or 10%氯漂白剂清洗手术工具 , 并用蒸馏水冲洗 , 最后用酒精冲洗 。

文章图片
图1:脑立体定位仪 。 (1)耳棒;(2)齿棒;(3)注射器支架;(4)设置垂直坐标的螺钉;(5)设置横向
坐标的螺钉;(6)设置前后坐标的螺钉;(7)垂直游标刻度;(8)侧游标刻度;(9)前后游标刻度 。

文章图片
【维真生物】AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
二.静脉注射AAV9
(一)新生小鼠的颞静脉注射
1. 调整光源位置以便照亮显微镜区域 , 中等强度的光照最佳 。
2. 将一个新生幼鼠直接置于冰上1-3min , 进行麻醉 。
3. 当动物在冰上麻醉时 , 在注射器中注满AAV病毒 。 体积不应超过100μL , 体积在30到100μL之间不会影响转导效率 。
4. 在显微镜下观察幼鼠 。 用不持注射器的手的食指放在幼鼠口鼻处 , 中指放在耳芽处 , 以便拉伸幼鼠的皮肤 , 可见颞浅静脉 。
5. 确定颞浅静脉 。 可通过皮肤看到位于耳芽前部 , 周围毛细血管下部 , 有一条隐约可见的静脉血管 , 从背部到腹部 , 汇入颈静脉 , 这就是颞浅静脉 。
6. 注射器针尖斜面插入颞静脉 。 可以看到针尖斜面通过皮肤的以后被血填充 。 轻压注射器 , 并注意幼鼠脸侧面的静脉变白 。
(二)成年小鼠的尾静脉注射
1. 确保动物进入约束装置 。
2. 用酒精擦拭尾巴 。
3. 把尾巴置于温水中 。
4. 将注射器吸满AAV病毒悬液 。
5. 将注射器插入尾静脉中 。 如果没有瞄准 , 可以靠近尾巴根部再试一次 。
6. 注射病毒溶液 。 体积控制在100-250μL 。
7. 将小鼠放回笼内 。

文章图片
图2:动物约束装置
三.AAV从周围神经到目标神经元的逆行运输
1.选取250g左右的大鼠 , 通过25 G 1毫升注射器注射甲苯噻嗪(10mg/kg)和氯胺酮(100mg/kg) 。
2.将麻醉后的大鼠置于无菌布上 。 在每只眼睛中滴入一滴聚丙烯酸 , 以防麻醉造成眼睛干燥 。
3.刮去肌肉附近的毛发并用酒精清洁 。 用刀片在皮肤上切一个小口 , 并用钳保持刀口开放 , 以暴露肌肉 。
4.使用超微量注射器吸入AAV病毒悬液 , 并排除空气和气泡 。
5.挤压肌肉以使肌肉建立起一定的厚度 , 并把针尖置于肌肉上 。
6.缓缓插入针尖 , 并在肌肉中静置1min 。 然后以10μl/min的速度注入10-20μl的AAV悬液 。
7.注射结束后 , 将针在肌肉中静置2min , 然后缓缓拔出 。 可进行多次注射 。
8.缝合皮肤并做耳标 。 将大鼠单独放在一个干净的笼子里 , 直到醒来
9.先用0.1 M NaOH or 10%氯漂白剂清洗手术工具 , 并用蒸馏水冲洗 , 最后用酒精冲洗 。
【模型|知识分享:AAV在中枢神经系统研究中的注射方法】
文章图片
图3:超微量注射器
推荐阅读
- 新机|快准稳,捕捉每个高光瞬间! 刘衡分享EOS R5拍摄体验
- 问答|紧追B站加码知识类内容,抖音上线“学习频道”
- 显示器|华光昱能知识--DP2.0跟DP1.4有那些不一样?
- 审判|直接服务“三城一区”主平台,怀柔科学城知识产权巡回审判庭成立
- 词条|百度百科上线2500万词条,超750万用户参与共创科普知识内容
- 模型|2022前展望大模型的未来,周志华、唐杰、杨红霞这些大咖怎么看?
- 风险|筛选风险词、用实体类型推断限售商品,阿里安全夺冠知识图谱大赛
- 字节跳动|抖音上线学习频道,为知识内容增加一级入口
- 知识科普|直管内径、凸缘管内径密封快速接头 管内壁粗糙的管口格雷希尔GripSeal连接器
- 训练|华为运动健康 Beta 新版本测试:新增健身课程分享、血压挑战计划







