一、AAV产品简介
腺相关病毒(AAV)是一种无包膜的单链DNA病毒 , 基因组大小约4.7kb , 通常需要腺病毒、疱疹病毒等辅助病毒的帮助 , 才能进行自我复制 。 野生型AAV基因组编码两大开放阅读框架rep和cap , 它们位于两侧的末端倒转重复序列(ITRs)之间 。 下图为rAAV进入细胞和转运的过程 。
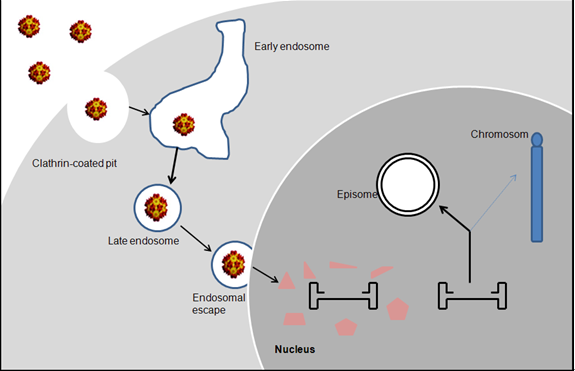
文章图片
二、AAV基因传递和表达的优势
【实验|维真生物:AAV产品技术手册】1.宿主范围广:随时可转染的AAV可高效感染分裂和非分裂细胞;
2.多种血清型 :AAV1, AAV2, AAV5, AAV6, AAV7, AAV8 、AAV9、AAV-retro和AAV-php等;
3.安全性高:ITR 序列和 rep/cap 基因分别由独立的质粒表达;未发现AAV对人体致病 , rAAV去除了wtAAV基因组的96% , 进一步保证了安全性;
4.免疫原性低:AAV2 的基因组仅 4681 个核苷酸 , 便于用常规的重组 DNA技术进行操作 , 而且进行动物实验时造成的免疫反应小;
5、表达时间长:AAV可在宿主细胞中形成附加体(episome)存在于细胞核中 , 在细胞分裂不旺盛的组织中可持续表达半年以上 。
6、特异性强:不同血清型AAV的衣壳蛋白识别细胞表面的受体不同 , 因而对不同组织细胞的侵染效率差异很大 , 特定血清型AAV能实现对特定类型细胞组织特异性的高效转导 。
三、如何选择病毒载体
在选择合适的病毒载体之前 , 你可能需要考虑以下几个因素:
1、外源基因的大小:鉴于每种病毒的包装容量有限 , 因此插入片段的长度 , 是需要首先考虑的因素;
2、基因表达时间:结合每种载体各自的特点并综合实验方案来选择病毒载体;
3、做体内还是体外实验:以AAV为例 , 由于其安全性高 , 免疫原性低等特点 , 可能更适于做体内实验;腺病毒可以快速表达 , 慢病毒则更加适合构建稳转株;
4、是否需要更强特异性表达:除去病毒自身感染的特点 , 如实验需要更强特异性 , 则AAV由于其血清型多、组织特异性启动子多 , 可选择性会更强 。 您可以参照下表选择合适的病毒载体:
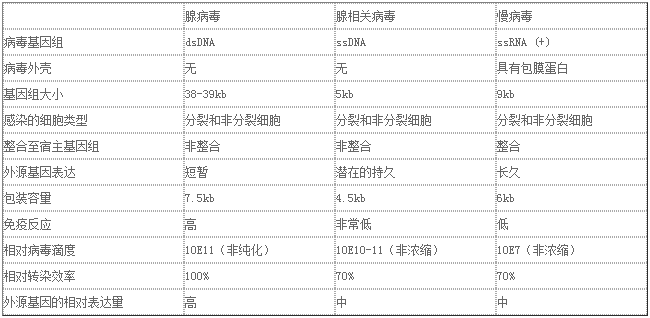
文章图片
四、AAV生产流程简介
维真生物腺相关病毒包装采用的是经典的三质粒共转染法(Helper-free AAV 包装系统 , 即AAV无辅助病毒系统) , 该系统包括3个载体和1株包装细胞:3个载体【载体质粒(含有目的基因表达盒 , 其两端是AAV2 的倒转末端重复序列)、包装质粒(反式提供具有AAV复制和包装功能的蛋白Rep和Cap)和辅助质粒(含有辅助病毒Ad5的重要元件E1a、E1b、E2a、E4等】和1株包装细胞(HEK293T cell) 。
第一步基因克隆
将外源基因克隆进入维真生物公司的人源或shRNA腺相关病毒载体 , pAV-FH AAV 等载体的多克隆位点与我们的human ORF 穿梭克隆相兼容 , 非常适于哺乳动物ORF的表达 。
第二步病毒包装
将携带外源基因的重组质粒与辅助质粒Ad Helper Vector和pAAV-rep/cap Vector 共转染进入HEK293T细胞 , 感染72h之后即包装完毕 。
第三步收毒
分别收获培养基上清与细胞沉淀 , PEG8000沉淀培养基上清中的病毒 , 培养基上清先用0.45um滤膜过滤 。
第四步纯化浓缩
通过碘克沙醇法对病毒进行纯化 , 一方面提高病毒滴度 , 另一方面 , 某些动物实验需要纯化之后才可进行 。 纯化完成后 , 再将收集到的病毒液置于超滤管中进行浓缩 。
第五步滴度和特异性检测
首先通过qPCR的方法来检测病毒滴度 , 利用PCR的方法进行病毒特异性检测 , 最后用银染方法核实病毒纯度 。
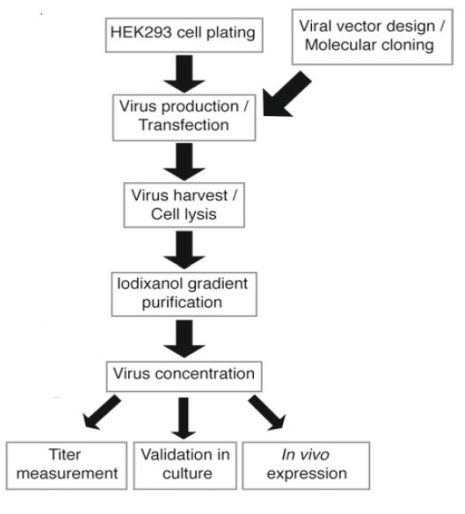
文章图片
腺相关病毒包装的具体示意图(维真生物)
文章图片
AAV病毒银染结果图(维真生物)
五、维真生物腺相关病毒(AAV)服务类型
1、腺相关病毒(AAV)载体克隆服务
—人源cDNA ORF克隆
—shRNA克隆服务
2、腺相关病毒(AAV)包装服务
—AAV过表达包装服务
—AAV干扰包装服务
—AAV-CRISPR包装服务
六、维真生物腺相关病毒服务优势:
1)载体全:近30多种组织特异性启动子(神经特异性启动子Synapsin、CamkIIα、GFAP等)和多种报告基因(EGFP、mCherry、RFP和luciferase等)可供客户选择; 2)货期短:AAV克隆载体均与我们18,000个预制人类全长cDNA ORF克隆载体MCS区通用 , 行业中生产周期短; 3)滴度高:可提供 1012V.G/ml及以上滴度的病毒. , 最高可达10E14VG/mL; 4)多种血清型:AAV1、AAV2、AAV5、AAV6、AAV7、AAV8、AAV9、AAV-retro、AAV-php等;
5)安全性高:ITR序列和rep/cap基因分别由独立的质粒表达; 6)免疫原性低:AAV2 的基因组仅 4681 个核苷酸 , 便于用常规的重组 DNA技术进行操作 , 而且进行动物实验时造成的免疫反应小;
7)表达稳定:能介导基因的长期稳定表达 。
推荐阅读
- 产品|泰晶科技与紫光展锐联合实验室揭牌
- 疫苗|中国生物:全球首支获批使用二代新冠疫苗将在阿联酋用于序贯接种
- 生物化学|我国卓越科技论文总体产出持续增长
- Samsung|三星生物技术:收购美生物技术公司渤健的消息不实
- 植物|开放生物资源,保护多样性:我们为了生物安全的那些努力。
- 生物地球化学过程|我国科学家发现第五条甲烷产生途径
- IT|传三星集团洽谈收购美生物技术公司渤健 后者股价大涨逾9%
- 样本|国内首个在库运行超百万份生物样本全自动化库落户广州
- 团队|生物技术成茶产业提质“金钥匙”
- 中国|微软 Azure 动手实验营-1月课程预告







