
文章图片
滴定是我们常用的定性、定量分析方法之一 , 中学化学开始我们就学习滴定 , 关于滴定你都知道哪些内容呢?
滴定分析概述
1、滴定分析
又称容量分析 , 它是根据已知准确浓度的溶液(标准溶液)和被测物质完全作用时所消耗的体积计算被测物质含量的方法 。
滴定:滴定标准溶液的过程
化学计量点(等当点):滴加的标准溶液与待测组分恰好反应完全的这一点 。
滴定终点:依据指示剂的颜色变化确定的等当点 。
滴定误差:滴定终点与等当点之间存在的误差 。
2、滴定分析的基本条件
(1) 反应完全:不得有副反应;
(2) 反应要迅速:否则要加热或加入催化剂;
(3) 必须有确定的等当点:要选用合适的指示剂;
(4) 不能有干扰杂质存在:如有要设法消除 。
3、滴定分析类型(根据反应的类型可分为四类)
(1) 酸碱滴定法:建立在酸碱反应基础上的滴定分析方法
例如滴定反应:H++OH- → H2O
(2) 沉淀滴定法:建立在沉淀反应基础上的滴定分析方法
例如银量法:Ag++Cl- → AgCl
(3) 配位滴定法:建立在配位反应基础上的滴定分析方法
例如EDTA滴定法:Mn2++H2Y2- → MnY+2H+
(4)氧化还原滴定法:建立在氧化还原反应基础上的滴定分析方法
例如:
高锰酸钾法:
MnO4-+5Fe2++8H+ → Mn2+ +5Fe3++4 H2O
碘量法:
I2+2S2O32- → S4O62-+2I-
4、滴定分析法的分类
(1)直接滴定法:用标准溶液直接滴定被测物质 , 是滴定分析法中最常用的基本的滴定方法 。 凡能满足滴定分析要求的化学反应都可用直接滴定法 。
(2)返滴定法:又称剩余滴定法或回滴法 。 当反应速度较慢或反应物是固体时 , 滴定剂加入样品后反应无法在瞬间定量反应 , 可先加入一定过量的标准溶液 , 待反应定量完成后用另一种标准溶液滴定剩余的标准溶液 。
(3)置换滴定法:对于不按确定化学计量关系反应的物质 , 有时可以通过其他化学反应间接进行滴定 , 即加入适当试剂与待测物质反应 , 使其被定量地置换成另一种可直接滴定的物质 , 再用标准溶液滴定此生成物 。
(4)间接滴定法:对于不能和滴定剂直接起反应的物质 , 有时可以通过另一种化学反应 , 以滴定法间接进行滴定 , 这种方法称为间接滴定法 。
常见滴定液配制
1.配制EDTA滴定液:
①可加热促使溶解 , 先浓配后稀释 , 摇匀后放24h为好 , 使其充分稳定 。
②标定前氧化锌炽灼一定要到800℃ , 色泽应达鲜黄绿色 , 否则其中二氧化碳难以除尽 。
③注意pH值变化 , 先滴加氨试液中和盐酸后加水稀释 。
④铬黑T粉末放置不能过久 , 否则灵敏度差 , 指示液应逐滴加 , 充分振摇 。
2.配制醇制氢氧化钾滴定液:
①因AR级KOH标示含量为82实际上均为80左右 , 所以应为理论量355g 。
②乙醇中醛类受光线作用呈深浅不同黄色故乙醇需精制无醛乙醇 , 精制后应立即放冷配制 , 制法见中国药典2000年版附录 。
③防止二氧化碳与乙醇挥发 , 光照影响 , 应贮存于橡皮塞棕色玻璃瓶中 , 而且临用新标定 。
3.配制四苯硼钠滴定液:
①加新制Al(OH)3凝胶 , 使滤液澄清 , 强力振摇使溶解完全 , 先滤上清液 。
②做好空白 , 滴定中特别是近终点速度要很慢 , 注意观察色泽变化 , 贮存期间出现浑浊应重新标定 。
4.配制亚硝酸钠滴定液:
①加无水碳酸钠作稳定剂用 , 使pH值保持在10左右 , 铂电极应临用前活化好 。
②在试样加入前加KBr以促进反应 。
③室温应30℃用胶管连接滴定管插入到液面下2/3处避免硝酸分解 , 计算好理论量“先快后慢”特别是近终点 , 逐滴加入 , 并搅拌 。
5.配制草酸滴定液:
①酸化应用硫酸 , 不可用硝酸或盐酸(硝酸有氧化性而盐酸易被高锰酸钾氧化) 。
②近终点前加速反应加热可用水浴 , 直火加热温度难以控制 , 且温度太高草酸分解而使结果不准确 。
6.配制氢氧化钠滴定液:
①用饱和氢氧化钠液制备应新沸冷水制成而且应陈化6小时左右 。 排除碳酸钠干扰与二氧化碳 。
②制备饱和氢氧化钠时应分多次加入氢氧化钠固体 , 过饱和后应放置三天后取上清液 , 应一次取出避免倒流而冲浑液体 。
③也可用新制热蒸馏水 , 但制好后应放至室温 , 尽量避免二氧化碳干扰 。
④基准应在玛瑙乳钵中研细 , 利于溶解 , 在终点前基准应全溶解 , 否则结果有误 。
⑤标定前贮存聚乙烯塑料瓶中 , 用虹吸法取用 , 进气管前端用钠石灰和棉花过滤 , 定期或钠石灰变色后更换 , 防止二氧化碳影响浓度 。
7.配制重铬酸钾滴定液:
①基准应先研细 , 在120℃干燥至恒重 , 放冷后立即称量配制 。
②最好是棕色瓶 , 浓配摇匀使溶后再加水至刻度 。
8.配制烃铵盐滴定液:
①氮化二甲基苄基烃在溶解过程应逐步缓加 , 防止粉末漂浮 , 应加强搅拌 , 必要时放入超声波助溶 , 先浓配后稀释为好 。
②标定时氯化钾用基准或色谱纯 , 其结果即准确且终点明确 。
9.配制高氯酸滴定液:
①是碱性基因的有机化合物 。 加入醋酐量应为理论量12-13倍 , 一般市售高氯酸含量普遍偏低 , 1000mL配制理论量85mL , 实际工作中取用96-98mL , 导致含水增大 , 所以应加入12倍左右的实际用量而保证含水量合格 。
②配制中先加醋酸将高氯酸稀释 , 以免反应剧烈 , 色泽变黄导致分解 , 滴加醋酐先振摇后滴加 , 速度宜慢不宜快 。
③避光保存或用黑布套在棕色瓶中 , 若溶液变成浅黄色 , 即 , 为分解不能再用 。
【化学|木木西里仪器说|滴定还有比这更全的吗?】10.配制高锰酸钾滴定液:
①煮沸过程要保持一段时间 , 促使其中还原性杂质反应完全 。 以免在以后贮存中引起浓度改变 。 过滤目的除去二氧化锰 。
②加新沸水目的除水中氧 , 以免标定过程中草酸钠被氧化使浓度偏高 。
③酸度调节用硫酸为好 , 总的浓度控制在0.5moL/L , 酸度低反应太慢 , 酸度太高又容易使高锰酸分解 。
11.配制硝酸银滴定液:
①宜避光配制 , 注意保护不要使皮肤或衣服上被污染 , 因为除掉较难 。
②标定系吸附指示剂 , 所以应保护生成氯化银呈胶体状肪 , 应在氯化钠溶解后再加糊精 。
③宜在中性或弱碱性中进行 , 加碳酸钙以利于形成荧光黄阴离子指示终点 。
④滴定中也应避光 , 特别是强光照射 。
12.配制硫代硫酸钠滴定液:
①煮沸应保持5分钟左右 , 利于清除二氧化碳与氧气 , 加碳酸钙作为稳定剂 , pH值应保持在弱碱性约pH值9-10防止分解 。
②放置30天以上是促反应完全 , 过滤除杂质 , 滴定过程取用50mL滴管为好 。
③标定中应避光 , 因碘化钾为强酸性 , 在静置过程也释放碘 , 应同时作空白 , 若贮存滴定液出现浑浊现象 , 即也分解不能用 。
13.配制硫酸亚铁滴定液:
①硫酸亚铁在空气中风化、氧化现象 , 配制应注意量的取用 。
②本溶水溶液不稳定 , 但在酸性条件下稳定 , 所以加硫酸:水40:20混合液保持稳定 。
14.配制硫酸铈铵滴定液:
①配制先将溶液溶解完全后加硫酸防水解 。
②因属于强氧化剂 , 用三氧化二砷标定 , 加氯化碘作催化剂 , 指示剂邻二氮菲中因含有少量铁也消耗滴定液使结果不准确 , 应注意加量 , 近终点加热是为了加速反应 。
15.配制硫酸锌滴定液:
硫酸锌应取无水硫酸锌 , 应注意区别无水或水硫酸锌 , 加盐酸是防止水解 。
16.配制碘滴定液:
①碘在水中不溶且有挥发性 , 配制用利用碘化钾的水溶液形成三碘络离子而溶解并降低挥发性 , 配制中先将碘化钾置锥形瓶中加水溶解成高浓度溶液 , 碘要在乳钵中研细后再加入锥形瓶中使溶解 , 振摇完全溶解后再加盐酸过滤医`学教育网搜集整理 。
②加盐酸保持微酸性 , 防止碘酸盐 , 同时也中和标定中稳定剂碳酸钠 。
③因有腐蚀性发性应贮存在棕色瓶中放置一周后标定 , 应避免有机物 。
④三氧化二砷难溶于水 , 加氢氧化钠液加热使成亚砷酸钠而溶 , 加硫酸调节pH值是因为碘量法不宜在碱性溶液中进行中和后加碳酸氢钠使其中性或微碱性pH 8左右 。
⑤配制淀粉指示剂加热时间宜短 , 应在冰浴快速冷却 , 这样灵敏高 , 终点易于观察 。
17.配制溴滴定液:
①取用在毒气柜或通风柜中进行 , 避免吸入中毒 , 避免手直接触及 , 避免伤害 。
②若直接滴定可临用新标 , 若用间接法 , 可不标定 , 因为有已标定硫代硫酸钠 。
配制溶液时的注意事项
1、分析实验所用的溶液应用纯水配制 , 容器应用纯水洗三次以上 。
2、溶液要用带塞的试剂瓶盛装 。
3、配制好的试剂应及时盛入试剂瓶 , 试剂瓶上必须有标液名称、浓度和配制人 , 配制日期 , 有效期限 。
4、溶液储存时应注意不要使溶液变质 。
5、配制硫酸、磷酸、硝酸、盐酸等溶液时 , 应把酸倒入水中 。
6、用有机溶剂配制溶液时(如 , 制指示剂溶液) , 可以在热水浴中温热溶解 , 不可直接加热 。
7、应熟悉一些常用溶液的配制方法及常用试剂的性质 。
8、不能用手直接接触腐蚀性及有剧毒的溶液 , 剧毒废液应作解毒处理 , 不可直接倒入下水道 。
玻璃容器的一般知识
1、滴定管、移液管、容量瓶(20℃时流出流入准确液体体积的量器)
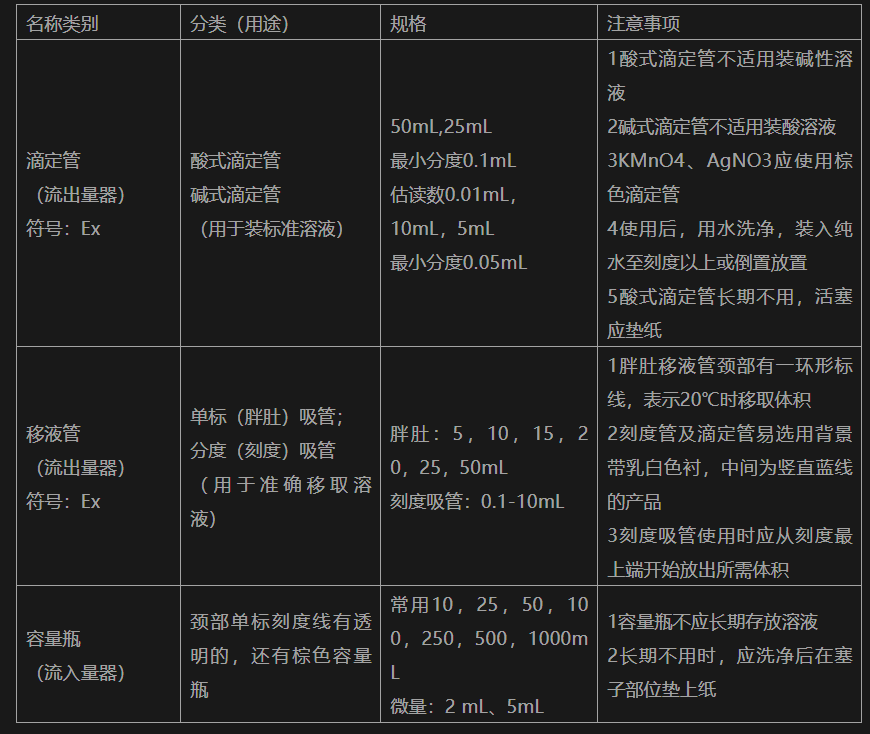
文章图片
2、容量仪器校正
(1)容量仪器的校正方法
a.称量一定体积的水;
b.然后根据该温度时水的密度;
c.将水的质量换算为容积 。
不同温度下水的密度都已准确地测定过 , 这是本校正方法的基本依据 。
校正依据:不同温度下的水的密度都已准确的测定过 , 例如15℃、20℃、25℃时的密度ρ依次为:997.93、997.18、996.17g/L;
校正方法:称量一定体积的水(克数) , 然后根据该温度时的水的密度(克/毫升) , 则可换算得水的容积(毫升);
校正后的容积:是指20℃时的真实容积 。 实际使用时不一定也在20℃ , 因此要水在不同温度换算为20℃时的溶剂增减的量 , 可疑进行校正 。 例如:15℃:+0.8mL/L;25℃:-1.0 mL/L 。
(2)滴定管和移液管的校正
用上述方法(绝对矫正法)通过称量、换算方法进行校正 。 可以分段校正其误差 , 并计算出分段校正值及 。 对比可绘制出 。 对此可绘制出滴定管(或移液管)容积校正曲线 。
(3)容量瓶的校正(绝对校正法和相对校正法)
相对校正法:是指容量瓶与移液管配套校正 。 例如25 mL移液管与100 mL容量瓶的配套校正 , 并做好对应编号和新标样配套使用 。
3、移液管移取试液的“8字”操作要点
1高:吸取试试液至少高于刻度处;
2擦:从试液视野中取出移液管 , 用滤纸擦去管外试液;
3垂:管身垂直;
4靠:管尖紧靠贮液瓶口;
5切:试液弯月面与刻度相切;
6贴:管下端紧贴接受试液容器内壁;
7垂:使管垂直;
8等:试液流完等15-30s后取出移液管 。
4、玻璃仪器的洗涤方法
如何洗涤玻璃仪器 , 并无严格的程序 , 通常主要根据原有污垢的性质及程度进行 , 其洗涤方法通常遵循以下步骤:
(1)倾尽仪器内原有的东西 该步骤不仅有利于后续的洗涤 , 更可以防止意外事故的发生 。 例如 , 若仪器内残存的金属钠未完全倾尽 , 遇水则可能爆炸 , 产生安全事故 。 所以 , 该步骤切不可忽略 。
(2)用水洗 根据所用仪器的种类和规格 , 选择合适的毛刷 , 蘸水刷洗 , 洗去 , 洗去灰尘和可溶性物质 。
(3)用洗涤机洗 用毛刷蘸取洗涤剂溶液 , 反复刷洗 , 然后边刷边用水冲洗 , 当倾去水后 , 器壁上不挂水珠 , 则已洗净 。
(4)进行完2、3两步之后用纯水少量分数次刷洗 , 洗去所沾的自来水 。 最少需刷洗3次 。
若用上述方法仍难洗净仪器 , 或不能使用毛刷刷洗的仪器 , 可根据污物的性质 , 选用适宜的洗液浸洗(铬酸洗液、纯酸洗液、碱性洗液、碱性乙醇洗液、碱性高锰酸钾洗液等) , 清洗时需要注意以下问题:
(1)应先用水、洗涤剂清洗 , 并将水倾尽后 , 再用洗液洗涤玻璃仪器 。
(2)用铬酸洗液洗涤时 , 可用少量的洗液浸泡刷洗 , 用过的洗液不能随意乱倒 , 只要洗液为变成绿色 , 应倒回原瓶 , 可下次再用 。
(3)在换用洗液时 , 必须要除尽前一种洗液 , 以免相互作用 , 降低洗涤效果 , 甚至生成更难洗涤的物质 。
(4)用洗液洗涤后 , 还需用自来水冲洗 , 再用纯水刷洗 。
(5)使用洗液浸泡、清洗玻璃仪器时 , 也可以在超声波清洗器中进行 。
内容来源:网路
文章图片

文章图片

文章图片
木木西里仪器说|一文读懂汗液传感器
木木西里仪器说|仪器类型简介-高压反应釜
木木西里仪器说|仪器类型简介-玻璃反应釜
特别声明:本文发布仅仅出于传播信息需要 , 并不代表本公共号观点;如其他媒体、网站或个人从本公众号转载使用 , 请向原作者申请 , 并自负版权等法律责任 。
推荐阅读
- 生物化学|我国卓越科技论文总体产出持续增长
- 生物地球化学过程|我国科学家发现第五条甲烷产生途径
- 技术|四川大学化学工程教师团队:做磷化工领域的忠诚卫士
- 安全风险|她为危险化学品补充安全“身份证”
- 合金|初中化学金属部分15个重要考点总结
- 地球|首张全球地球化学图编制完成
- 有机化学|构建长效机制 推动科学家进课堂
- 松果|CCF-百度松果基金青年学者论坛 百度与AI新青年产生的化学反应
- 材料|从寻金猎人到钛合金人造关节,这本书将重塑你的化学世界观
- 中科院物理所|元素如何左右人类文明的走向?化学史与人类史紧密相随







