第三章 铁金属材料
一、铁的单质
1.概述
在一定条件下 , 铁作为还原剂能与某些非金属单质、酸和盐溶液反应 。 铁与氧化性较弱的氧化剂反应时 , 生成+2价铁的化合物;铁与氧化性较强的氧化剂反应时 , 生成+3价铁的化合物 。
2.化学性质
(1)Fe与Cl2反应:2Fe+3Cl2==点燃==2FeCl3
(2)Fe与S反应:Fe+S==加热==FeS
(3)Fe与水蒸气反应:3Fe+4H2O(g)==高温==Fe3O4+4H2

文章图片
(4)Fe与FeCl3溶液反应:Fe+2FeCl3==点燃==3FeCl2
(5)Fe与O2反应:3Fe+2O2Fe3O4
二、铁的重要化合物
1.铁的氧化物

文章图片
2.铁的氢氧化物
(1)在FeSO4溶液中加入氢氧化钠溶液时 , 会先生成白色絮状Fe(OH)2沉淀 , Fe(OH)2易被空气中的氧气氧化生成Fe(OH)3 , 所以沉淀会迅速变成灰绿色 , 最后变为红褐色 , 方程式为4Fe(OH)2+O2+2H2O====4Fe(OH)3 。
(2)Fe(OH)3是红褐色、难溶于水的固体 , 加热时能失水生成红棕色氧化铁粉末 , 方程式为2Fe(OH)3==加热==Fe2O3+3H2O 。
3.铁盐和亚铁盐
(1)性质
Fe2+的溶液呈浅绿色 , Fe2+处于铁的中间价态 , 既有氧化性 , 又有还原性;
Fe3+的溶液呈棕黄色 , Fe3+处于铁的高价态 , 遇Fe、Cu、H2S等还原剂时表现为氧化性 。
(2)鉴别
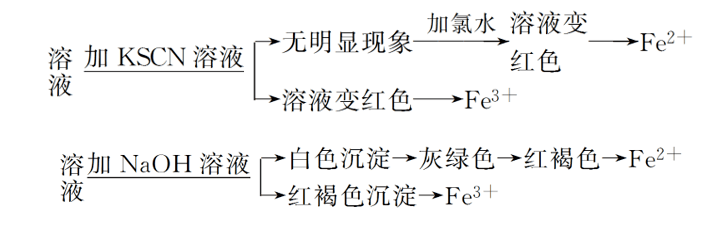
文章图片
(3)转化
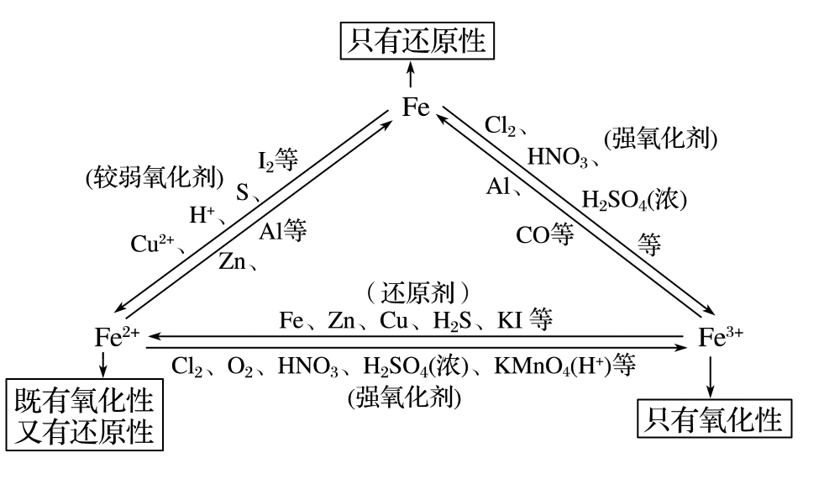
文章图片
三、铁合金
1.合金
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质 。 合金的熔点一般比它的成分金属低 , 但硬度和强度一般比它的成分金属大 。
2.铁碳合金
(1)生铁和钢是含碳量不同的两种铁碳合金 。 生铁的含碳量为2%~4.3% , 钢的含碳量为0.03%~2% 。
(2)钢是用量最大、用途最广的合金 。

文章图片
(3)不锈钢的主要合金元素是铬和镍 。
四、铝和铝合金
1.铝单质
(1)铝是地壳中含量最多的金属元素 。 铝是一种活泼金属 , 在常温下就能与空气中的氧气发生反应 , 表面生成一层致密的氧化铝薄膜 。
(2)铝是两性金属 , 与酸或者强碱都能发生反应:
2Al+6H+===2Al3++3H2↑
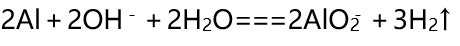
文章图片
2.氧化铝
氧化铝是两性氧化物 , 与酸或者强碱都能发生反应生成盐和水:
Al2O3+6H+===2Al3++3H2O
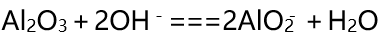
文章图片
3.氢氧化铝
氢氧化铝是两性氢氧化物 , 能与酸反应生成铝离子 , 或者与碱反应生成偏铝酸根离子:
Al(OH)3+3H+===Al3++3H2O
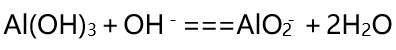
文章图片
五、新型合金
1.储氢合金
是一类能够大量吸收H2 , 并与H2结合成金属氢化物的材料 。 具有使用价值的储氢合金要求储氢量大 , 金属氢化物既容易形成 , 稍稍加热又容易分解 , 室温下吸、放氢的速率快 。
2.钛合金
钛合金强度高、耐蚀性好、耐热性高 。 主要用于制作飞机发动机压气机部件 , 以及火箭、导弹和高速飞机的结构件 , 还可以用于制造耐压球 。
第四章 物质结构元素周期律
一、原子结构
1.原子的构成
(1)原子的定义:原子是化学变化中的最小微粒 。
(2)构成微粒及作用
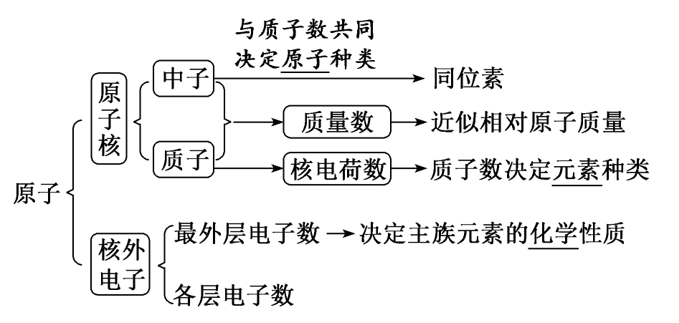
文章图片
2.数量关系
质量数(A )=质子数(Z )+中子数(N )
3.微粒符号及其意义
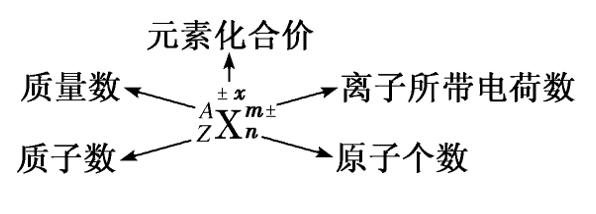
文章图片
4.核外电子排布规律
(1)电子先从内层排起 , 一层充满后再填充下一层;
(2)第n层最多能容纳的电子数为2n2;
(3)最外层电子数最多为8个(K层只有2个) 。
二、元素周期表
1.原子序数
(1)定义:按照元素在周期表中的顺序给元素所编的序号 。
(2)数量关系:原子序数=核电荷数=核外电子数=质子数 。
2.元素周期表的编排原则

文章图片
3.元素周期表的结构
(1)周期(7个横行 , 7个周期)
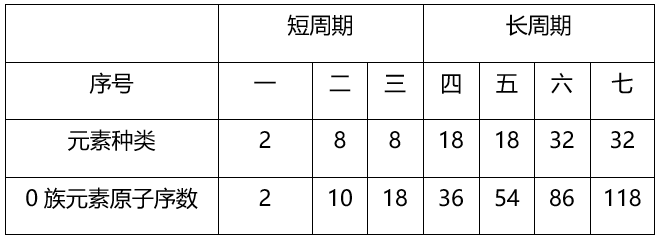
文章图片
(2)族(18个纵列 , 16个族)
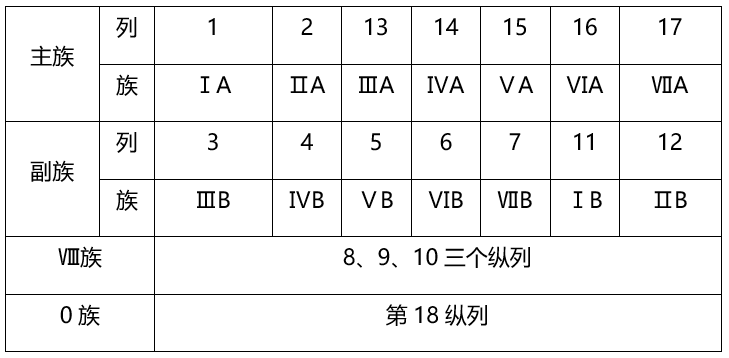
文章图片
三、核素
1.元素、核素、同位素
具有一定数目质子和一定数目中子的一种原子叫做核素 , 质子数相同而中子数不同的同一元素的不同原子互称同位素(同一元素的不同核素互称同位素) 。
2.同位素的性质
化学性质几乎完全相同 , 但物理性质不同 。
3.重要核素的应用
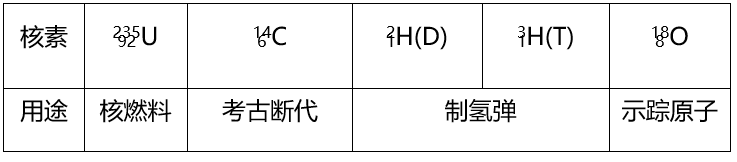
文章图片
4. 核素和元素的相对原子质量
(1)原子(即核素)的相对原子质量:一个原子(即核素)的质量与12C质量的1/12的比值 。 一种元素有几种同位素 , 就有几种不同核素的相对原子质量 。
(2)元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值 。 如:Ar(Cl)=Ar(35Cl)×a %+Ar(37Cl)×b % 。
四、原子结构与元素的性质
1.碱金属元素
(1)在周期表中的位置:第ⅠA族
(2)相似性
碱金属元素原子的最外层都有1个电子 , 很容易失去 , 因此碱金属元素的最高正价为+1价 , 最高价氧化物对应的水化物均为强碱(LiOH除外) 。
(3)递变性
从Li到Cs , 随着电子层数的增加 , 原子半径递增 , 碱金属元素原子的失电子能力递增 , 元素的金属性递增 , 单质的还原性递增 , 单质与氧气或水反应的剧烈程度递增 , 最高价氧化物对应的水化物的碱性递增 。
(4)物理性质
碱金属单质都有银白色的金属光泽(铯略带金色光泽)、硬度小、密度小、熔沸点较低 , 良好的导电、导热性 , 有延展性 。
2.卤族元素
(1)在周期表中的位置:第ⅦA族
(2)相似性
卤素原子的最外层都有7个电子 , 很容易得到一个电子 , 因此卤素原子的最低负价为-1价 , 最高正价为+7价(氟元素除外) 。 卤素单质均具有氧化性 , 氢化物都是强酸(HF除外) 。
(3)递变性
从F到I , 随着电子层数的增加 , 原子半径递增 , 卤素原子的得电子能力递减 , 元素的非金属性递减 , 单质的氧化性递减 , 离子的还原性递增 。 与氢气反应的剧烈程度递增 , 气态氢化物的稳定性递减 , 氢化物溶液的酸性递增 , 最高价氧化物对应的水化物的酸性递减 。
(4)卤素单质间的置换反应
2NaBr+Cl2===2NaCl+Br2
2KI+Cl2===2KCl+I2
2KI+Br2===2KBr+I2
(5)物理性质
卤素单质都有颜色 , 有毒 , 在水中溶解度不大 , 易溶于苯、汽油、四氯化碳、酒精等有机溶剂 。 从F2到I2 , 颜色逐渐加深 , 熔、沸点逐渐升高 , 密度逐渐增大 , 在水中的溶解度逐渐减小 。
五、元素性质的周期性变化规律
1.元素周期律
元素的性质随着原子序数的递增呈现周期性的变化 。
2.同周期元素性质递变规律
在同一周期中 , 从左到右 , 核电荷数逐渐增加 , 原子半径逐渐减小 , 失电子能力逐渐减弱 , 得电子能力逐渐增强 。 元素的金属性逐渐减弱 , 非金属性逐渐增强 。 单质的还原性逐渐减弱 , 氧化性逐渐增强 。 气态氢化物的热稳定性逐渐增强 。 最高价氧化物对应的水化物的酸性逐渐增强 , 碱性逐渐减弱 。
3.同族元素性质递变规律
在同一族中 , 从上到下 , 核电荷数逐渐增加 , 原子半径逐渐增大 , 失电子能力逐渐增强 , 得电子能力逐渐减弱 。 元素的金属性逐渐增强 , 非金属性逐渐减弱 。 单质的还原性逐渐增强 , 氧化性逐渐减弱 。 气态氢化物的热稳定性逐渐减弱 。 最高价氧化物对应的水化物的酸性逐渐减弱 , 碱性逐渐增强 。
六、元素周期表和与元素周期律的应用
1.元素周期表的分区
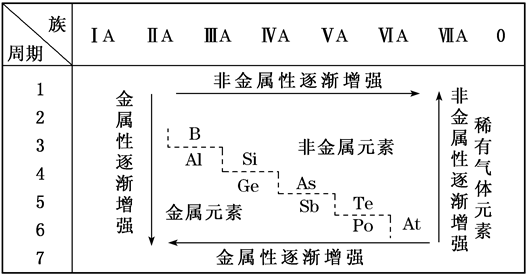
文章图片
2.元素化合价与位置的关系
(1)主族元素的最高正化合价等于它所处的族序数;
(2)非金属元素的最高正化合价 , 等于原子所能失去或偏移的最外层电子数(O、F除外);而最低负化合价等于使原子达到8电子稳定结构所需得到的电子数 。
(3)非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于8 。
3.元素周期律的应用
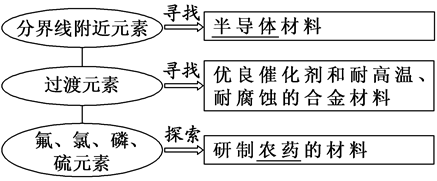
文章图片
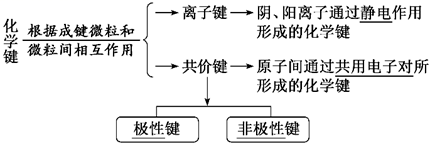
七、化学键
1.概念:相邻原子之间强烈的相互作用 。
2.分类
文章图片
3.比较

文章图片
4.类型判断
(1)从物质构成角度判断

文章图片
(2)从物质类别角度判断
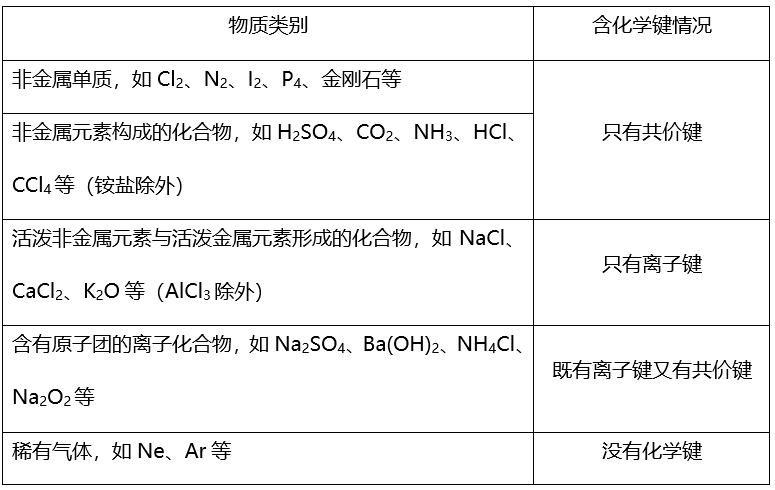
文章图片
5.电子式
(1)概念:在元素符号周围用“·”或“×”来表示原子的最外层电子的式子 。
(2)书写方法

文章图片
(3)用电子式表示化合物的形成过程
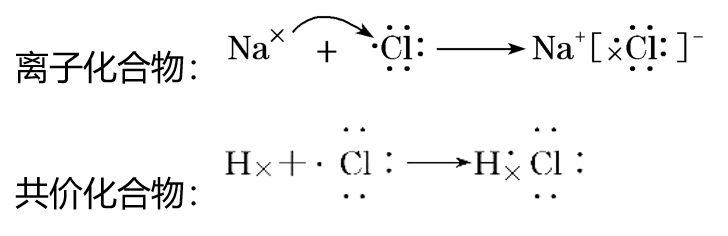
文章图片
6.离子化合物与共价化合物
【必修|干货丨化学人教版【必修一】第三、四章知识点总结】
文章图片
推荐阅读
- 解决方案|【干货】反渗透设备结垢原因及解决方案
- 视界|这部电影里的黑洞竟然和真实黑洞这么像?丨夜问
- 虚拟|半月谈丨元宇宙的未来,是美好还是陷阱?
- 合成|AI合成主播丨“十四五”期间力争突破一批机器人核心技术和高端产品
- 罗振宇|张庭夫妇公司涉嫌传销被查处;小米正式宣布对标苹果丨邦早报
- 产品|走进园区企业丨用尖端材料学解决医学难题
- 足迹|远古发现丨2021年这些有关“远古”的新发现,哪个曾让你大吃一惊?
- 化石|远古发现丨2021年这些有关“远古”的新发现,哪个曾让你大吃一惊?
- 情感|没开玩笑!对湖水喊话,它真的会回应丨智言智语
- 长江|新华全媒+丨“长江明白” 乘风破浪的追“星”族






