E药观察家 42家药企将接受现场检查!

文章图片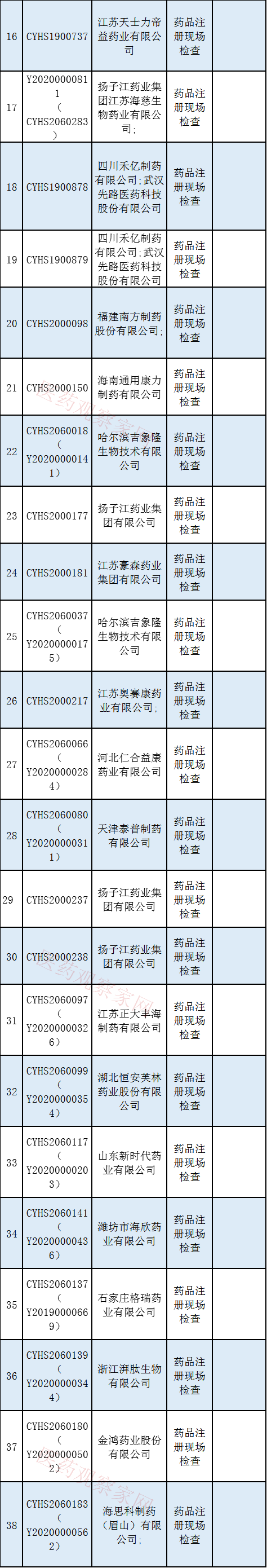
文章图片
1月5日 , 国家药监局食药审核查验中心发布了两则关于药品注册申请药学研制和生产现场检查任务信息公告 。
两则公告指出:审核查验中心已接收药品审评中心发起《药品注册管理办法》(市场监管总局令第27号)实施前受理的51个药品注册申请的药学研制和生产现场检查任务以及按照第48条规定启动的第六批6个药品注册申请的药学研制和生产现场核查任务 。 大部分为药品注册现场检查 , 只有辰欣药业股份有限公司是一致性评价检查 。
此次将接受检查的药企共有42家 , 其中河南真实生物科技有限公司、凯莱英医药集团(天津)股份有限公司、江苏恒瑞医药股份有限公司、上海合全医药有限公司、和记黄埔医药(上海)有限公司将优先接受审评 , 请这几家药企提前做好检查准备;江苏恒瑞医药股份有限公司重复提交过申请不必再次提交 。 具体完整药品检查情况见下表:
【E药观察家|42家药企将接受现场检查!】
根据原《药品注册管理办法》(国家食品药品监督管理局局令第28号) , 已接收到药品审评中心相关申请生产现场检查通知文件的注册申请人 , 且自认为具备接受现场核查条件的 , 需在规定时间内登陆我中心网站(www.cfdi.org.cn) , 通过“药品注册申请人之窗”或“网上办事-在线申请”栏目提交药品注册申请生产现场检查的申请 。 中心将根据药品注册申请人可以接受现场检查的时间等安排 , 组织现场检查工作 , 其中优先审评品种予以优先安排 。
请相关药品注册申请人予以关注 , 逾期不提交 , 中心将按照有关规定终结相关检查任务 , 并回复药品审评中心 。
内容来源:医药观察家网
整理:No.nine
推荐阅读
- 大一小白女生咋一步一步变得时尚
- 经济参考报 实控人减持频现 34家药企拟减持规模上限达169亿元
- 最新消息 科兴疫苗获WHO批准 科兴制药20%涨停:回应称不是一家
- 人物 萧敬腾在上海接种国药疫苗:自称早就想打、目前一切安好
- IT 巴西本月将启动自产新冠疫苗活性药物成分工作
- 中国经济网 星源卓镁、欣巴科技、百诚医药6月9日创业板首发上会
- 新能源 白酒医药新能源基金全线回调,接下来要不要减仓呢?
- 电子商务 亚马逊支持大麻合法化 并调整对工人的药物检测政策
- 送男朋友啥篮球鞋比较好
- 康美药业 破产重整,康美药业度一切苦厄?







